对于可逆反应:2A(g)+B(g) 2C(g) △H<0,下列各图中正确的是( )
2C(g) △H<0,下列各图中正确的是( )
A.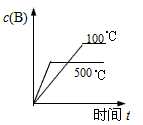 |
B.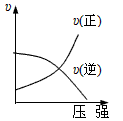 |
C.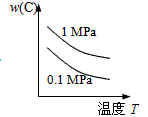 |
D.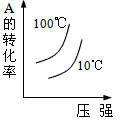 |
在其他条件不变时,下列说法正确的是( )
| A.增大压强一定会破坏气体反应的平衡状态 |
| B.升高温度可使化学平衡向放热的方向移动 |
| C.使用催化剂只能改变反应速率,不能改变化学平衡状态 |
| D.增大反应物浓度或减小生成物浓度,平衡向逆反应方向移动 |
反应PCl5(g) PCl3(g)+Cl2(g) ① 2HI(g)
PCl3(g)+Cl2(g) ① 2HI(g) H2(g)+I2(g) ②。在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
H2(g)+I2(g) ②。在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
| A.均增大 | B.均不变 |
| C.①增大,②不变 | D.①减小,②不变 |
对已经达到化学平衡状态的下列反应2X(g)+Y2(g) Z(g),减小压强时,对反应产生的影响是( )
Z(g),减小压强时,对反应产生的影响是( )
| A.v正、v逆都减小,平衡逆向移动 | B.v正、v逆都增大,平衡正向移动 |
| C.v逆增大,v正减小,平衡逆向移动 | D.v逆减小,v正增大,平衡正向移动 |
在一定温度下,可逆反应A(g)+3B(g)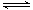 2C(g)达到平衡状态的标志是( )
2C(g)达到平衡状态的标志是( )
A.A、B、C的浓度相等
B.C的生成速率与C的分解速率相等
C.A、B、C的分子数目之比为1:3:2
D.单位时间内,生成1molA,同时生成3molB
在平衡2CrO42-(黄色)+2H+ Cr2O32-(橙红色)+H2O中,溶液介于黄色和橙红色之间,欲使溶液的橙红色加深,则要在溶液中加入( )
Cr2O32-(橙红色)+H2O中,溶液介于黄色和橙红色之间,欲使溶液的橙红色加深,则要在溶液中加入( )
| A.H+ | B.OH- | C.K+ | D.H2O |
体积恒定的密闭容器中,反应2SO2(g)+O2(g)  2SO3(g) △H<0,达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正向移动的是( )
2SO3(g) △H<0,达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正向移动的是( )
| A.移去SO3 | B.加入催化剂 | C.通入O2 | D.降低温度 |
一定温度下,在2.5L的恒容密闭容器中发生如下反应:CO2(g)+H2S(g)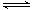 COS(g)+H2O(g)
COS(g)+H2O(g)
| 实验 |
温度/K |
起始物质的量/mol |
平衡物质的量/mol |
平衡常数 |
|
| CO2 |
H2S |
H2O |
|
||
| I |
607 |
0.11 |
0.41 |
0.01 |
|
| II |
607 |
0.22 |
0.82 |
|
|
| III |
620 |
0.1 |
0.4 |
|
6.74×10-3 |
下列说法不正确的是
A.该反应正反应为吸热反应
B.607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行
C.实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D.实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变
某温度时,在2L恒容密闭容器中,X、Y、Z三种气态物质的变化曲线如图所示,关于其变化的一些说法正确的是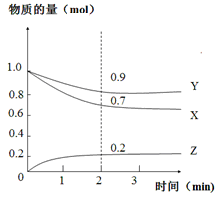
A.该反应的化学方程式:3X+Y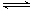 2Z 2Z |
| B.反应开始至2min,Z的平均反应速率:0.1mol/(L·min) |
| C.若在3min后,把Z从反应体系中分离,平衡不移动 |
| D.用X表示该化学反应速率比用Y表示的要快 |
下列有关研究化学反应原理的叙述中,正确的是
| A.研究化学反应中的能量变化,有利于通过改变反应条件,使同一反应消耗相同量的物质而放出更多的热,提高化学能的利用率 |
| B.任何放热的化学反应,均可以利用原电池直接把化学能转化为电能 |
| C.研究化学反应速率与化学平衡,有利于指导实际生产中达到“多,快,好,省”的生产效率 |
| D.使用催化剂常常可以加快化学反应速率,但不能提高反应物的转化率,因此在实际生产中较少使用催化剂 |
化学与STSE(社会、科学、技术和环境)密切相关,下列说法正确的是
①寻找合适催化剂提高合成氨工业中原料的转化率
②氟氯烃分解产生的氯原子因能降低臭氧分解的活化能而加速臭氧的分解反应
③氟化物防止龋齿所涉及到的化学原理其实就是沉淀的转化
④煤气中毒或救治与氧气、一氧化碳和血红蛋白结合过程中的化学平衡移动有关
| A.①②③ | B.②③④ | C.①④ | D.③④ |
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g) + 3H2(g)  2NH3(g) ΔH="-92.4" kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g) ΔH="-92.4" kJ/mol。实验测得起始、平衡时的有关数据如下表:
| 容器编号 |
起始时各物质的物质的量/mol |
平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量 a kJ |
| ② |
2 |
3 |
0 |
放出热量 bkJ |
| ③ |
2 |
6 |
0 |
放出热量 ckJ |
下列叙述正确的是
A.放出热量关系:a<b<92.4 B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③ D.N2的平衡转化率:②>①>③
已知H2(g)+I2(g)  2HI(g) ΔH<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.2 mol,乙中加入HI0.4 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2HI(g) ΔH<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.2 mol,乙中加入HI0.4 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
| A.甲、乙提高相同温度 | B.甲降低温度,乙不变 |
| C.甲中加入0.2 mol He,乙不改变 | D.甲增加 0.2 mol H2,乙增加0.2 mol I2 |
在密闭容器中进行反应CH4(g)+H2O(g) CO(g)+ 3H2(g)ΔH>0 ,测得c(CH4) 随反应时间(t)的变化曲线如图所示。下列判断正确的是
CO(g)+ 3H2(g)ΔH>0 ,测得c(CH4) 随反应时间(t)的变化曲线如图所示。下列判断正确的是 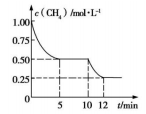
| A.0~5 min 内,v(H2)="0.1" mol·(L·min)-1 |
| B.反应进行到12 min时,CH4的转化率为 25% |
| C.恒温下,缩小容器的体积,平衡后 H2的浓度减小 |
| D.10 min 时,改变的外界条件可能是升高温度 |