某温度下,在一容积可变的密闭容器中,反应A(g) + 2B(g)  2C(g)达到平衡时,A、B和C的物质的量分别为2mol、4mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
2C(g)达到平衡时,A、B和C的物质的量分别为2mol、4mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
A.均加倍 B.均减半 C.均减小1 mol D.均增加1 mol
难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后加入适量碘并封管,置于加热炉中,发生反应: 。下列说法正确的是
。下列说法正确的是
| A.在不同温度区域,TaI4 的量保持不变 |
| B.在提纯过程中,I2 的量不断减少 |
| C.该反应的平衡常数与TaI4 和S2 的浓度乘积成反比 |
| D.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区 |
向体积为2 L的密闭容器中充入2 mol SO2和1 mol O2,测得起始容器压强为p,一定条件下发生反应:2SO2(g)+O2(g)  2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,测得平衡时容器内压强为0.7p,若此时再向容器中充入充入2 mol SO3达到新平衡时,容器内的压强为1.4p,则下列说法正确的是
2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,测得平衡时容器内压强为0.7p,若此时再向容器中充入充入2 mol SO3达到新平衡时,容器内的压强为1.4p,则下列说法正确的是
| A.充入2 mol SO3后,SO2的物质的量增大 |
| B.第一次反应达到平衡时共放出热量176.4 kJ |
| C.充入2 mol SO3达到新平衡时,容器内的压强为1.4p |
| D.降低容器的温度可使新平衡时各物质的体积分数与第一次平衡时相同 |
工业上以乙苯催化脱氢制取苯乙烯的反应如下: (g)
(g)
 (g) + H2(g)
(g) + H2(g)
现将x mol乙苯蒸气通入体积可变的密闭容器中反应,维持体系总压强p总恒定。在某催化剂作用下,乙苯的平衡转化率随温度变化如图所示。已知:气体分压(p分)=气体总压(p总)× 体积分数。
不考虑副反应,下列说法正确的是
| A.400℃时,向体系中通入水蒸气,v(正)、v(逆) 均减小,且乙苯转化率降低 |
| B.500℃时,向体系中通入乙苯、苯乙烯、氢气各0.1x mol,平衡不移动 |
C.550℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= × p总 × p总 |
| D.550℃时平衡体系中苯乙烯的体积分数是450℃时的3倍 |
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g)  2XY3(g),△H=-92.6 kJ·mol-1
2XY3(g),△H=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
1 |
3 |
0 |
放热 23.15 kJ |
| ② |
0.6 |
1.8 |
0.8 |
Q(Q>0) |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量Q为23.15kJ
C.达平衡时,两个容器中XY3的物质的量浓度均为2mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
已知某可逆反应 mA(g)+ nB(g)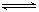 pC(g),在密闭容器中进行,下图表示在 不同反应时间 t、温度 T 和压强 P 与反应物 B 在混合气体中的百分含量 B%的关系曲线,由曲线分析,下列判断正确的是( )
pC(g),在密闭容器中进行,下图表示在 不同反应时间 t、温度 T 和压强 P 与反应物 B 在混合气体中的百分含量 B%的关系曲线,由曲线分析,下列判断正确的是( )

| A.T1<T2、P1>P2、m+n>p,△H <0; |
| B.T1>T2、P1<P2、m+n>p,△H >0; |
| C.T1>T2、P1<P2、m+n<p,△H >0; |
| D.T1<T2、P1>P2、m+n<p,△H <0; |
在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表.据此判断下列结论正确的是
| 测定时刻/s |
t1 |
t2 |
t3 |
t4 |
| c(A)/(mol/L) |
6 |
3 |
2 |
2 |
| c(B)/(mol/L) |
5 |
3.5 |
3 |
3 |
| c(C)/(mol/L) |
1 |
2.5 |
3 |
3 |
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B⇌2C
D.在t2~t3内A的平均反应速率为:[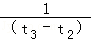 ]mol/(L•s)
]mol/(L•s)
下列相关实验能达到预期目的的是( )
| |
相关实验 |
预期目的 |
| A |
相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和醋酸中,观察气泡产生的快慢 |
验证固体接触面积对化学反应速率的影响 |
| B |
可逆反应FeCl3(aq)+3KSCN(aq) Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 |
验证浓度对化学平衡的影响 |
| C |
室温下,向BaSO4悬浊液中加入饱和Na2CO3溶液,过滤后,再向沉淀中加入盐酸,沉淀部分溶解 |
验证BaSO4和BaCO3Ksp的相对大小 |
| D |
相同温度下,两支试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量的MnO2固体 |
验证不同催化剂对H2O2分解速率的影响 |
相同温度下,相同体积的甲、乙两容器,保持体积不变,甲容器中充入1g SO2和1g O2,乙容器中充入2g SO2和2g O2。下列叙述错误的是( )
| A.化学反应速率:乙>甲 | B.平衡时O2的浓度:乙>甲 |
| C.平衡时SO2的转化率:乙>甲 | D.平衡时SO2的体积分数:乙>甲 |
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
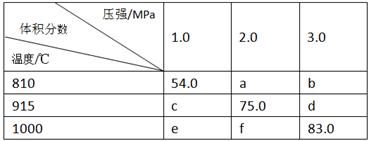
①a<54 ;②该反应的ΔS>0 ;③ 915℃、2.0MPa时E的转化率为60%;
④ 该反应ΔH<0;⑤ K(1000℃)>K(810℃);
上述①~④中正确的有( )
| A.5个 | B.4个 | C.3个 | D.2个 |
下图所示与对应叙述相符的是( )
A.一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X + 3Y Z Z |
| B.图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂 |
| C.常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示。当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是C- |
将可逆反应:2NO2←→2NO+O2在固定容积的密闭容器中进行,达到平衡的标志是
①单位时间内消耗n mol O2的同时,生成2n mol NO2
②单位时间内生成n mol O2的同时,消耗2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的密度不再改变的状态
⑤混合气体的颜色不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.②⑤⑥ |
在1升密闭容器中,加入5 mol A物质,在一定条件下同时发生下列两个反应:(1)2A(g) 2B(g)+C(g);(2)A(g)
2B(g)+C(g);(2)A(g) C(g)+D(g)。当达到平衡时,测得c(A)="2.5" mol·L-1,c(C)="2.0" mol·L-1。则下列说法中正确的是:
C(g)+D(g)。当达到平衡时,测得c(A)="2.5" mol·L-1,c(C)="2.0" mol·L-1。则下列说法中正确的是:
A.达到平衡时A的总转化率为40%
B.达到平衡时c(B)为1.0 mol·L-1
C.达到平衡时c(B)=2c(D)
D.达到平衡时c(D)为0.5 mol·L-1
已知图一表示的是可逆反应CO(g)+H2(g)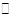 C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)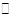 N2O4(g)ΔH<0的浓度(c)随时间(t)的变化情况。下列说法正确的是
N2O4(g)ΔH<0的浓度(c)随时间(t)的变化情况。下列说法正确的是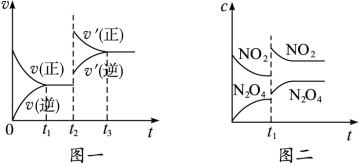
| A.图一的t2时刻和和图二的t1时刻改变的条件都有可能是升高了温度或增大了压强 |
| B.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
| C.图一表示在新条件下达到平衡时,v′(正)>v′(逆),图二表示在新条件下达到平衡时,v′(正)<v′(逆) |
| D.其它条件不变,分别使用不同催化剂上述反应的平衡常数均不变 |