可逆反应2A(g)+B(g) 2C(g),根据下表中的数据判断下列图象错误的是( )
2C(g),根据下表中的数据判断下列图象错误的是( )


在一个容积为6L的密闭容器中,放入3LX(g)和2LY(g),在一定条件下发生反应:4X(g)+nY(g) 2Q(g)+6R(g)达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应中的n值是
2Q(g)+6R(g)达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应中的n值是
| A.3 | B.4 | C.5 | D.6 |
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+c(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是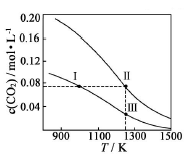
A.反应CO2(g)+C(s) 2CO(g) △S>0、△H<0 2CO(g) △S>0、△H<0 |
| B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ) |
| C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) |
| D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态)) |
在一定温度下,X 与 Y 发生反应:X(aq)+m Y(aq)  n Z(aq),下图为反应在不同条件下达到平衡时,X、Y、Z 三种物质的平衡浓度。甲为1L溶液中 X与Y按起始物质的量比 5:7 混合,使反应达到平衡。乙和丙是将甲溶液按不同比例稀释后,使反应重新达到平衡。下列判断正确的是
n Z(aq),下图为反应在不同条件下达到平衡时,X、Y、Z 三种物质的平衡浓度。甲为1L溶液中 X与Y按起始物质的量比 5:7 混合,使反应达到平衡。乙和丙是将甲溶液按不同比例稀释后,使反应重新达到平衡。下列判断正确的是
| A.m :n =" 3" :2 | B.K = 8 |
C.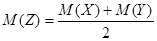 |
D.起始物质的量n(X)=1mol |
下列图示与对应叙述相符合的是
A.图I:反应N2+3H2 2NH3在恒温情况下,反应速率与压强的关系 2NH3在恒温情况下,反应速率与压强的关系 |
B.图Ⅱ:反应H2+I2 2HI达平衡后,升高温度时反应速率随时间的变化 2HI达平衡后,升高温度时反应速率随时间的变化 |
C.图III:反应CO2(g)+H2(g) CO(g)+H2O(g)ΔH>0,水蒸气含量随时间的变化 CO(g)+H2O(g)ΔH>0,水蒸气含量随时间的变化 |
D.图IV:反应2SO2+O2 2SO3达平衡后,缩小容器体积,各成分物质的量随时间的变化 2SO3达平衡后,缩小容器体积,各成分物质的量随时间的变化 |
对于可逆反应:2A(g)+B(g) 2C(g) △H<0,下列各图中正确的是( )
2C(g) △H<0,下列各图中正确的是( )
A.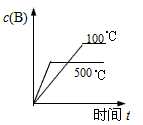 |
B.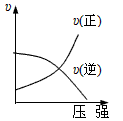 |
C.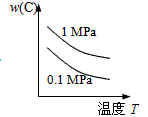 |
D.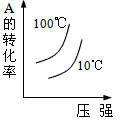 |
反应PCl5(g) PCl3(g)+Cl2(g) ① 2HI(g)
PCl3(g)+Cl2(g) ① 2HI(g) H2(g)+I2(g) ②。在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
H2(g)+I2(g) ②。在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
| A.均增大 | B.均不变 |
| C.①增大,②不变 | D.①减小,②不变 |
一定温度下,在2.5L的恒容密闭容器中发生如下反应:CO2(g)+H2S(g)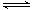 COS(g)+H2O(g)
COS(g)+H2O(g)
| 实验 |
温度/K |
起始物质的量/mol |
平衡物质的量/mol |
平衡常数 |
|
| CO2 |
H2S |
H2O |
|
||
| I |
607 |
0.11 |
0.41 |
0.01 |
|
| II |
607 |
0.22 |
0.82 |
|
|
| III |
620 |
0.1 |
0.4 |
|
6.74×10-3 |
下列说法不正确的是
A.该反应正反应为吸热反应
B.607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行
C.实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D.实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变
某温度时,在2L恒容密闭容器中,X、Y、Z三种气态物质的变化曲线如图所示,关于其变化的一些说法正确的是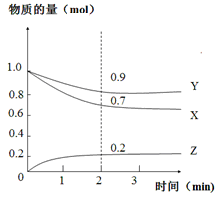
A.该反应的化学方程式:3X+Y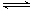 2Z 2Z |
| B.反应开始至2min,Z的平均反应速率:0.1mol/(L·min) |
| C.若在3min后,把Z从反应体系中分离,平衡不移动 |
| D.用X表示该化学反应速率比用Y表示的要快 |
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g) + 3H2(g)  2NH3(g) ΔH="-92.4" kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g) ΔH="-92.4" kJ/mol。实验测得起始、平衡时的有关数据如下表:
| 容器编号 |
起始时各物质的物质的量/mol |
平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量 a kJ |
| ② |
2 |
3 |
0 |
放出热量 bkJ |
| ③ |
2 |
6 |
0 |
放出热量 ckJ |
下列叙述正确的是
A.放出热量关系:a<b<92.4 B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③ D.N2的平衡转化率:②>①>③
已知H2(g)+I2(g)  2HI(g) ΔH<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.2 mol,乙中加入HI0.4 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2HI(g) ΔH<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.2 mol,乙中加入HI0.4 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
| A.甲、乙提高相同温度 | B.甲降低温度,乙不变 |
| C.甲中加入0.2 mol He,乙不改变 | D.甲增加 0.2 mol H2,乙增加0.2 mol I2 |
在密闭容器中进行反应CH4(g)+H2O(g) CO(g)+ 3H2(g)ΔH>0 ,测得c(CH4) 随反应时间(t)的变化曲线如图所示。下列判断正确的是
CO(g)+ 3H2(g)ΔH>0 ,测得c(CH4) 随反应时间(t)的变化曲线如图所示。下列判断正确的是 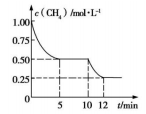
| A.0~5 min 内,v(H2)="0.1" mol·(L·min)-1 |
| B.反应进行到12 min时,CH4的转化率为 25% |
| C.恒温下,缩小容器的体积,平衡后 H2的浓度减小 |
| D.10 min 时,改变的外界条件可能是升高温度 |
在容积固定的密闭容器中存在如下反应:N2(g)+3H2(g) 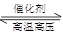 2NH3(g) ΔH<0。 某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出如下关系图。下列叙述正确的是( )
2NH3(g) ΔH<0。 某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出如下关系图。下列叙述正确的是( )
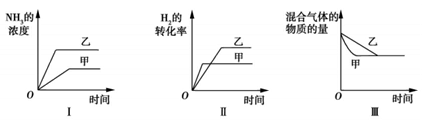
| A.图Ⅰ研究的是温度对反应的影响,且甲的温度比乙的高 |
| B.图Ⅱ研究的是温度对反应的影响,且甲的温度比乙的高 |
| C.图Ⅱ研究的是压强对反应的影响,且甲的压强比乙的大 |
| D.图Ⅲ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率比甲使用的高 |
一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算,分压=总压X物质的量分数。在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便。下列说法不正确的是( )
A.对于C2H4 (g) + H2O(g) = C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为1 mol,则用分压表示的平衡常数Kp = 3/P
B.恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)=2C(g)达到平衡时,A、B和 C的物质的量分别为4mol、2mol和4mol,若此时A、B和C均增加1mol,平衡正向移动
C.恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)=2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充人3molN2,则平衡正向移动
D.对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关
已知:碘单质能与I-反应成I3-,并在溶液中建立如下平衡:I2+I=I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。某同学为测定上述平衡体系中C(I2),采用如下方法:取V1mL平衡混合溶液,用cmol•L-1的Na2S203溶液进行滴定(反应为I2+2Na2S203 2NaI+Na2S406),消耗V2mL的Na2S203溶液。 根据V1、V2和c可求得c(I2)。下列对该同学设计方案的分析,正确的是
| A.方案可行,能准确测定溶液中的c(I2) |
| B.方案可行,可采用淀粉做该滴定反应的指示剂 |
| C.不可行,只能测得溶液中c(I2)与c(I3-)之和 |
| D.不可行,因为I能与Na2S203溶液反应 |