将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
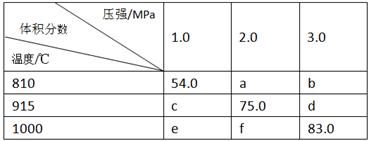
①a<54 ;②该反应的ΔS>0 ;③ 915℃、2.0MPa时E的转化率为60%;
④ 该反应ΔH<0;⑤ K(1000℃)>K(810℃);
上述①~④中正确的有( )
| A.5个 | B.4个 | C.3个 | D.2个 |
对于可逆反应mA(g)+nB(s) pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是 ( )
pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是 ( )
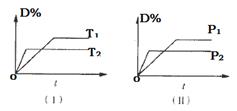
| A.降温,化学平衡向逆反应方向移动 |
| B.使用催化剂可使D%有所增加 |
| C.化学方程式中气体的化学计量数m<p+q |
| D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 |
在某容积一定的密闭容器中,有下列可逆反应:A(g)+B(g) xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )

| A.P3<P4,y轴表示B的体积分数 |
| B.P3<P4,y轴表示混合气体的密度 |
| C.P3>P4,y轴表示B的百分含量 |
| D.P3>P4,y轴表示混合气体的平均摩尔质量 |
向甲、乙两个容积均为1L的恒容容器中分别充入2molA、2molB和1molA、1molB。相同条件下发生如下反应:A(g)+B(g)  xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示。下列说法错误的是( )
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示。下列说法错误的是( )

A.x可能等于2也可能等于3
B.若向平衡后的乙容器充入C,则再次达到平衡时A的体积分数减小
C.若升高甲容器的温度,可使甲容器中各物质的体积分数与乙容器相同
D.若其它条件不变,使乙容器体积变为2L,则平衡时乙容器中:0.25mol/L<c(A)<0.5mol/L
一定温度下将0.2 mol气体A充入10 L恒容密闭容器中,进行反应:
2A(g)+B(g) 2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如下表所示,则下列说法正确的是
2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如下表所示,则下列说法正确的是
| t/min |
2 |
4 |
6 |
8 |
10 |
| n(A)/mol |
0.16 |
0.13 |
0.11 |
0.10 |
0.10 |
A.反应前2 min的平均速率ν(C) ="0.02" mol·L-1·min-1
B.平衡后降低温度,反应达到新平衡前ν(逆)> ν(正)
C.其他条件不变,10 min后再充入一定量的A,平衡正向移动,A的转化率变小
D.保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同
FeCl3与KSCN混合时存在下列平衡:Fe3++SCN﹣⇌[Fe( SCN)]2+.已知平衡时,物质的量浓度c[Fe( SCN)]2+与温度T的关系如图,则下列说法正确的是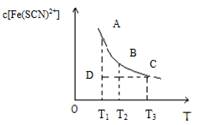
| A.FeCl3与KSCN反应的热化学反应方程式为:Fe3++SCN﹣⇌ [Fe( SCN)]2+△H>0 |
| B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1>K2 |
| C.反应处于D点时,一定有V正>V逆 |
| D.T2温度下,向B点溶液中加入FeCl3固体,平衡状态会从 B点变到A点 |
向2L密闭容器中加入1 mol NO和1 mol活性炭,发生反应:
2NO(g)+C(s) N2(g)+CO2(g) ΔH=﹣213.5 kJ/mol,达到平衡时数据如下:
N2(g)+CO2(g) ΔH=﹣213.5 kJ/mol,达到平衡时数据如下:
| 温度/℃ |
n(活性炭)/mol |
n(CO2)/mol |
| T1 |
0. 70 |
_______ |
| T2 |
_______ |
0.25 |
下列说法不正确的是
A.上述信息可推知:T1<T2
B.T1℃时,该反应的平衡常数K=9/16
C.T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
D.T2℃时,若反应达平衡后再缩小容器的体积,c(N2)/c(NO)不变
如图所示,隔板K1固定不动,活塞K2可自由移动。T℃时,M、N两个容器中均发生反应N2(g)+3H2(g) 2NH3(g),向容器M、N中各充入l mol N2和3 mol H2,初始M、N的容积和温度相同,并保持温度不变。下列说法中不正确的是
2NH3(g),向容器M、N中各充入l mol N2和3 mol H2,初始M、N的容积和温度相同,并保持温度不变。下列说法中不正确的是 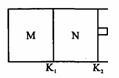
| A.反应达到平衡时N2的转化率:M<N |
| B.H2的体积分数:M<N |
| C.NH3的浓度:M<N |
| D.该反应在T℃时的平衡常数K:M=N |
已知某可逆反应:mA(g)+nB(g)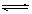 pC(g);△H 在密闭容器器中进行,如图所示,反应在不同时间t,温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是
pC(g);△H 在密闭容器器中进行,如图所示,反应在不同时间t,温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是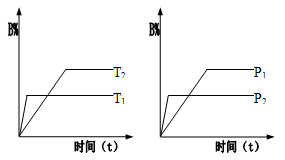
| A.T1<T2,P1>P2,m+n>p,△H>0 |
| B.T1>T2,P1<P2,m+n<p,△H>0 |
| C.T1>T2,P1<P2,m+n<p,△H<0 |
| D.T1>T2,P1>P2,m+n>p,△H<0 |
温度为T时,向2.0 L恒容密闭容器中充入2.0 mol NO2,反应2NO2(g) N2O4(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O4(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s |
0 |
50 |
150 |
250 |
350 |
| n(N2O4)/mol |
0 |
0.12 |
0.18 |
0.20 |
0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率为v(NO2)=0.0012 mol·L-1·s-1
B. 保持温度不变,向平衡后的容器中充入1.0 mol N2O4时,v(正)>v(逆)
C. 保持其他条件不变,升高温度达到新平衡时K=0.125,则反应的ΔH<0
D. T温度时,若起始向容器中充入2.0 mol N2O4,则平衡时N2O4的转化率大于80%
下列四个图像的有关说法正确的是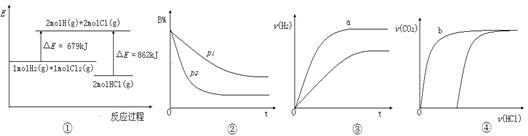
| A.①表示反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的△H="183" kJ·mol-1 |
B.②表示其它条件不变时,反应4A(g)+3B(g) 2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体 2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体 |
| C.③表示体积和pH均相同的HCl、CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示的是HCl溶液 |
| D.④表示10 mL 0.1 mol·L-1 Na2CO3和NaHCO3两种溶液中,分别滴加0.l mol/L HCl溶液时,CO2的体积随盐酸体积的变化,则b表示的是NaHCO3溶液 |
已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=﹣49.0kJ•mol﹣1。一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中正确的是
A.升高温度能使 增大 增大 |
| B.反应达到平衡状态时,CO2的平衡转化率为75% |
| C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D.从反应开始到平衡,H2的平均反应速率υ(H2)="0.075" mol•L-1•min-1 |
工业上以乙苯催化脱氢制取苯乙烯的反应如下: (g)
(g)
 (g) + H2(g)
(g) + H2(g)
现将x mol乙苯蒸气通入体积可变的密闭容器中反应,维持体系总压强p总恒定。在某催化剂作用下,乙苯的平衡转化率随温度变化如图所示。已知:气体分压(p分)=气体总压(p总)× 体积分数。
不考虑副反应,下列说法正确的是
| A.400℃时,向体系中通入水蒸气,v(正)、v(逆) 均减小,且乙苯转化率降低 |
| B.500℃时,向体系中通入乙苯、苯乙烯、氢气各0.1x mol,平衡不移动 |
C.550℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= × p总 × p总 |
| D.550℃时平衡体系中苯乙烯的体积分数是450℃时的3倍 |