可逆反应: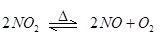 在密闭容器中反应,达到平衡状态的标志是( )
在密闭容器中反应,达到平衡状态的标志是( )
(1)单位时间内生成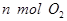 的同时生成
的同时生成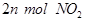
(2)单位时间内生成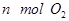 的同时生成
的同时生成
(3)用 的物质的量浓度变化表示的反应速率的比为2:2:1的状态
的物质的量浓度变化表示的反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的密度不再改变的状态
(6)混合气体的平均相对分子质量不再改变的状态
| A.(1)(4)(6) | B.(2)(3)(5) |
| C.(1)(3)(4) | D.(1)(2)(3)(4)(5)(6) |
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g) CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
下列分析中不正确的是
| A.图Ⅰ研究的是t0时升高温度对反应速率的影响 |
| B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 |
| D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
在一体积不变的密闭容器中发生如下化学反应:2A(g) B(g)+C(g)。当物质A的起始浓度为1.0 mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:
B(g)+C(g)。当物质A的起始浓度为1.0 mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示: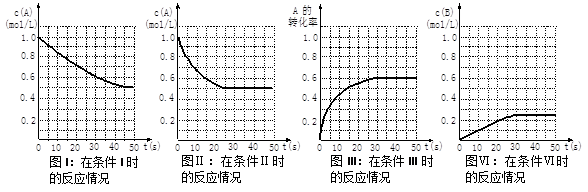
则下列有关说法中正确的是
A.条件I、条件II时的反应温度不同,压强相同
B.条件I时可能未使用催化剂,条件II时可能使用了催化剂
C.条件III时的平衡混合物中,物质C的浓度等于0.6 mol·L-1
D.条件IV和条件II相比较,条件IV时可能缩小了容器体积
有三个容积相同的容器①②③中均发生如下反应3A(g)+ B(g) 2C(g);△H<0,①容器容积固定,外有隔热套 ②容器容积固定 ③容器有活塞可移动。下列说法正确的是
2C(g);△H<0,①容器容积固定,外有隔热套 ②容器容积固定 ③容器有活塞可移动。下列说法正确的是
A.若维持温度不变,起始时②中投人3mol A、1 mol B;③中投入3 mol A、l mol B和2mol C,则达到平衡时,两容器中B的转化率②=③
B.若起始温度相同,分别向三个容器中充入3 mol A和1mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为③>②>①
C.若起始温度相同,分别向三个容器中充入1 mol A和1molB则达到平衡时各容器中C物质的百分含量一定相同
D.若起始温度相同,分别向三个容器中充入3a mol A和a molB则达到平衡时各容器中A物质的转化率一定相同
下列说法中,能说明化学平衡一定向正反应方向移动的是 ( )
A.N2O4(g) 2NO2(g),改变某一条件后,气体颜色加深 2NO2(g),改变某一条件后,气体颜色加深 |
B.H2(g)+I2(g) 2HI(g),单位时间内消耗H2和HI的物质的量之比大于1∶2 2HI(g),单位时间内消耗H2和HI的物质的量之比大于1∶2 |
C.N2(g)+3H2(g) 2NH3(g),改变某一条件后,NH3的体积分数增加 2NH3(g),改变某一条件后,NH3的体积分数增加 |
D.2SO2(g)+O2(g) 2SO3(g),恒温恒压条件下,充入He 2SO3(g),恒温恒压条件下,充入He |
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)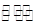 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
A.该反应的化学平衡常数表达式是K=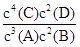 |
| B.此时,B的平衡转化率是35% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增加C,B的平衡转化率不变 |
在密闭容器中发生反应:aX(g) + bY(g) cZ(g) + dW(g),反应达到平衡后,保持温度不变,将气体体积压缩到原来的1/2,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
cZ(g) + dW(g),反应达到平衡后,保持温度不变,将气体体积压缩到原来的1/2,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
| A.平衡向逆反应方向移动 | B.a + b < c + d |
| C.Z的体积分数增大 | D.X的转化率下降 |
下列事实可以用勒夏特列原理解释的是
| A.新制的氯水在光照条件下颜色变浅 |
| B.使用催化剂,提高合成氨的产量 |
| C.高锰酸钾(KMnO4)溶液加水稀释后颜色变浅 |
| D.H2、I2、HI平衡混合气体加压后颜色变深 |
反应aM(g)+bN(g) cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如下图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是( )
cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如下图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是( )
| A.同温同压同z时,加入催化剂,平衡时Q的体积分数增加 |
| B.同压同z时,升高温度,平衡时Q的体积分数增加 |
| C.同温同z时,增加压强,平衡时Q的体积分数增加 |
| D.同温同压时,增加z,平衡时Q的体积分数增加 |
一定温度下,反应N2(g)+3H2(g)  2NH3(g)达到化学平衡状态的标志是( )
2NH3(g)达到化学平衡状态的标志是( )
| A.N2、H2和NH3的质量分数不再改变 |
| B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2 |
| C.N2与H2的物质的量之和是NH3的物质的量的2倍 |
| D.单位时间里每生成1 mol N2,同时消耗2 mol NH3 |
某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g) 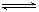 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则( )
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则( )
A.平衡不移动 B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C.再达平衡时,C的体积分数增大 D.再达平衡时,正反应速率增大,逆反应速率减小
某同学为试验CuS在不同酸中的溶解性,取4份黑色CuS粉末试样置于试管中,分别加入醋酸、浓盐酸、浓硫酸、浓硝酸溶液。观察到如下现象:
①CuS不溶于醋酸溶液;②CuS不溶于浓盐酸;③CuS不溶于浓硫酸;④CuS在浓硝酸中溶解,溶液变蓝,并有红棕色刺激性气体产生。
根据上述现象,该同学得出了以下结论,其中正确的是( )
| A.CuS不溶于弱酸,能溶于强酸 |
| B.CuS不溶于非氧化性酸,能溶于氧化性酸 |
| C.CuS溶于硝酸,是因为硝酸氧化性强于硫酸,S2-被氧化,使沉淀溶解平衡往溶解方向 移动 |
| D.CuS溶于硝酸,是因为硝酸的酸性大于硫酸和盐酸的酸性,S2-结合H+,放出H2S气体, |
使溶解沉淀平衡往溶解方向移动
在一定温度下的密闭容器中,不能表明A(s)+2B(g) C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是
| A.A的质量不再发生改变 | B.气体的总物质的量不再发生改变 |
| C.C的分子数不再发生改变 | D.D的物质的量浓度不再发生改变 |
下列变化不能用勒夏特列原理解释的是
| A.红棕色的NO2加压后颜色先变深再变浅 |
| B.H2、I2、HI混合气体加压后颜色变深 |
| C.向H2S水溶液中加入NaOH有利于S2-增多 |
| D.打开汽水瓶,看到有大量的气泡逸出 |