硫及其化合物在工业生产中有重要的应用,它们性质的研究对工业生产有重要的指导意义。
(1)2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。
2SO3(g),反应过程的能量变化如图所示。

已知1 mol SO2(g)氧化为1 mol SO3(g)放出的热量为99 kJ。请回答下列问题:
①图中E表示_____________,E的大小对该反应的反应热有无影响?_______________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____________,理由是_____________;
②图中ΔH=____________kJ·mol-1;
(2)下图表示在密闭容器中反应2SO2+O2 2SO3 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
2SO3 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。

①a b过程中改变的条件可能是 ;
②b c过程中改变的条件可能是 ;
③若增大压强时,反应速率变化情况画在c~d处。
已知某可逆反应:2M(g) N(g) △H<0。现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示。下列说法中,正确的是
N(g) △H<0。现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示。下列说法中,正确的是
| A.a、b、c、d四个点中处于平衡状态的点是a、b |
| B.反应进行至25 min时,曲线发生变化的原因是加入了0.4 mol N |
| C.若调节温度使35 min时体系内N的体积分数与15 min时相等,应升高温度 |
| D.若在40 min时出现如图所示变化,则可能是因为加入催化剂引起的 |
碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g) WI2(g)。为模拟上述反应,在实验室中准确称取0.508 g碘、0.736 g金属钨放置于50.0 mL密闭容器中,并加热使其反应。下图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)-t],其中曲线I(0 ~t2:时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
WI2(g)。为模拟上述反应,在实验室中准确称取0.508 g碘、0.736 g金属钨放置于50.0 mL密闭容器中,并加热使其反应。下图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)-t],其中曲线I(0 ~t2:时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
请回答下列问题:
(1)该反应是______________(填“放热”或“吸热”)反应。
(2)反应从开始到t1(t1 =3min)时间内的平均速率v(I2)=____________
(3)在450℃时,该反应的平衡常数K=_________________。
(4)能够说明上述反应已经达到平衡状态的有____________。
| A.I2与WI2的浓度相等 |
| B.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等 |
| C.容器内混合气体的密度不再增加 |
| D.容器内气体压强不变化 |
(5)假设灯丝温度为660℃,灯泡壁温度为350℃。请根据化学反应原理分析在灯泡内充入碘能够延长钨丝寿命的原因____________________________。
甲醇是一种新型的能源。(共12分)
(1)合成气(组成为H2和CO)是生产甲醇的重要原料,请写出由焦炭和水在高温下制取合成气的化学方程式 。
(2)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ;
(3)在T1温度时,将1 mol CO和2mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO转化率为a,则容器内的压强与起始压强之比为 ;
(4)在容积为l L的密闭容器中,由CO和H2合成甲醇。在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);下列说法正确的是 (填序号)

A.温度为T1时,从反应开始到平衡,生成甲 醇的平均速率为v(CH3OH)= (mol·L-1·min-1) (mol·L-1·min-1) |
| B.该反应在T1时c(CH3OH)与c2(H2)×c(CO)的比值比T2时c(CH3OH)与c2(H2)×c(CO)的比值大 |
| C.该反应为吸热反应 |
D.处于A点的反应体系从T1变到T2,达到平衡时 减小 减小 |
(1)已知某可逆反应mA(g)+nB(g)  qC(g)在密闭容器中进行。如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空:
qC(g)在密闭容器中进行。如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空:

①化学计量数的关系:m+n_________q;(填“>”.“<”或“=”)
②该反应的正反应为___________反应。(填“吸热”或“放热”)
③升高温度正反应速率 逆反应速率 (填“加快”或者“减慢”)但v正 v逆(填“>”.“<”或“=”)
(2)在FeCl3+3KSCN Fe(SCN)3+3KCl的平衡体系中,回答下列问题:(填“正向”、“逆向”、“不”)
Fe(SCN)3+3KCl的平衡体系中,回答下列问题:(填“正向”、“逆向”、“不”)
①在溶液中加入少量的KSCN固体,平衡 __________移动。
②在溶液中加入少量的KCl固体,平衡 _________移动。
在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)  M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
| 实验 编号 |
温度/℃ |
起始时物质的量/mol |
平衡时物质的量/mol |
|||
| n(X) |
n(Y) |
n(M) |
||||
| ① |
700 |
0.40 |
0.10 |
0.090 |
||
| ② |
800 |
0.10 |
0.40 |
0.080 |
||
| ③ |
800 |
0.20 |
0.30 |
a |
||
| ④ |
900 |
0.10 |
0.15 |
b |
||
下列说法正确的是
A.实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
(1)在2L的密闭容器中,由CO2和H2合成甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,
CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,
实验结果如图1所示(注:T2>T1,均大于300℃).
①温度为T2时,从反应开始到平衡,生成甲醇的平均反应速率为 .
②通过分析图1,温度对反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的影响可以概括为 .
CH3OH(g)+H2O(g)的影响可以概括为 .

③下列情形能说明上述反应已达到平衡状态的是 (填字母).
| A.体系压强保持不变 |
| B.密闭容器中CO2、H2、CH3OH(g)、H2O(g)4种气体共存 |
| C.CH3OH与H2物质的量之比为1:3 |
| D.每消耗1mol CO2的同时生成3mol H2 |
④已知H2(g)和CH3OH(l)的燃烧热△H分别为﹣285.8kJ·mol﹣1和﹣726.5kJ·mol﹣1,写出由CO2和H2生成液态甲醇和液态水的热化学方程式: .
(2)在容积可变的密闭容器中,由CO和H2合成甲醇CO(g)+2H2(g) CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图2所示.
CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图2所示.
①该反应的平衡常数表达式K= ,250℃、0.5×104 kPa下的平衡常数 (填“>”、“<”或“=”)300℃、1.5×104 kPa下的平衡常数.
,250℃、0.5×104 kPa下的平衡常数 (填“>”、“<”或“=”)300℃、1.5×104 kPa下的平衡常数.
②实际生产中,该反应条件控制在250℃、1.3×104 kPa左右,选择此压强而不选择更高压强的理由是 .
能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。
(1)用CO合成甲醇的反应为 。


 ;在容积为1L的密闭容器中分别充入1mol CO和2mol H2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的
;在容积为1L的密闭容器中分别充入1mol CO和2mol H2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的 (填“<”“>”或“=”)0。
(填“<”“>”或“=”)0。

(2)利用工业废水中的CO2可制取甲醇,其反应为

 。
。
①已知下列反应的能量变化如图所示:

由二氧化碳和氢气制备甲醇的热化学方程式为 。
②为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图1所示,从反应开始到平衡, .
.

(3)工业上可利用甲醇部分氧化法制取氢气。在一定温度下以 为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示。在制备H2时最好控制
为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示。在制备H2时最好控制 = 。
= 。
(1)在一容积为10L的容器中,通入一定量的CO和H2O,在850℃时发生反应CO(g)+H2O(g) CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)= mol·L-1·min-1,850℃时,此反应的平衡常数为 ,CO的转化率为 。
CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)= mol·L-1·min-1,850℃时,此反应的平衡常数为 ,CO的转化率为 。

(2) ℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
| t/min |
c(CO)/mol·L-1 |
c(H2O)/mol·L-1 |
c(CO2)/mol·L-1 |
c(H2)/mol·L-1 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
c1 |
c2 |
c3 |
c3 |
| 4 |
c1 |
c2 |
c3 |
c3 |
| 5 |
0.116 |
0.216 |
0.084 |
|
| 6 |
0.096 |
0.266 |
0.104 |
|
①从表中看出,3~4min之间反应处于 状态;c1 0.08(填“大于”、“小于”或“等于”)。
②反应在4~5min间,平衡向逆反应方向移动,可能的原因是 ,表中5~6min之间数值发生变化,可能的原因是 。
a.降低温度 b.增加水蒸气
c.增加氢气浓度 d.使用催化剂
已知反应:Fe(s)+CO2(g)  FeO(s)+CO(g)DH=akJ·mol-1
FeO(s)+CO(g)DH=akJ·mol-1
测得在不同温度下,该反应的平衡常数K值随温度的变化如下表所示:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
(1)该反应的化学平衡常数表达式为 ,若在500℃2L密闭容器中进行该反应,CO2起始量为4mol,5min后达到平衡状态,则v(CO)为 。
(2)若在700℃时该反应达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有 (填序号,下同)。不能增大化学反应速率的有 。
A.缩小反应容器的体积
B.通入适量CO2
C.加入适量铁
D.升高温度到900℃
E.使用合适的催化剂
(3)下列图像符合该反应的是 (填序号)(图中v代表速率、ω代表混合物中CO的含量,T代表温度)。

工业上可利用“甲烷蒸气转化法生产氢气”,反应为:
CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)
已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷平衡含量(%)的影响如下图1:

图1 (水碳比为3) 图2 (800℃)
(1)CH4(g)+H2O(g)  CO(g)+3H2(g)。的
CO(g)+3H2(g)。的 H 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向正应方向”、“向逆反应方向”或“不”)。
H 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向正应方向”、“向逆反应方向”或“不”)。
(2)温度对该反应的反应速率和平衡移动的影响是 。
(3)其他条件不变,请在图2中画出压强为2MPa时,甲烷平衡含量(%)与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(4)已知:在700℃,1MPa时,1mol CH4与1mol H2O在2L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在同温度下反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。数据如下:
| 容器编号 |
起始时各物质物质的量/mol |
达到平衡的时间/min |
达平衡时体系能量的变化/kJ |
||||
| CO |
H2O |
CO2 |
H2 |
||||
| ① |
1 |
4 |
0 |
0 |
t1 |
放出热量:32.8 kJ |
|
| ② |
2 |
8 |
0 |
0 |
t2 |
放出热量:Q |
|
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量 (填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为 %。
(3)计算容器②中反应的平衡常数K= 。
(4)下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q > 65.6 kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=4/Vt1mol/(L·min)
(5)已知:2H2(g)+O2(g)==2H2O(g)ΔH=-484kJ/mol,
写出CO完全燃烧生成CO2的热化学方程式: 。
在恒容条件下发生反应A(g)+3B(g) 2 C(g)(△H<0),改变其他反应条件,在Ⅰ、Ⅱ阶段体系中各物质浓度随时间变化的曲线如下图所示,下列说法中正确的是
2 C(g)(△H<0),改变其他反应条件,在Ⅰ、Ⅱ阶段体系中各物质浓度随时间变化的曲线如下图所示,下列说法中正确的是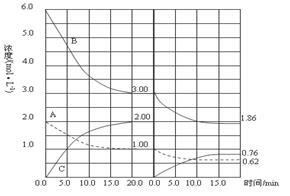
A.第Ⅰ阶段用C表示的平衡前的反应速率v (C)=0.1 mol/(L·s)
B.第Ⅱ阶段中B的平衡转化率αⅡ(B)为0.019
C.第Ⅰ阶段的平衡常数KⅠ与第Ⅱ阶段平衡常数KⅡ的大小关系是:KⅠ﹤KⅡ
D.由第一次平衡到第二次平衡,可能采取的措施是从反应体系中移出产物C
回答下列问题:
(1)“霾”是当今世界环境热点话题。目前宁夏境内空气质量恶化原因之一是机动车尾气和燃煤产生的烟气。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:2NO(g)+ 2CO(g) 2CO2(g)+N2(g) △H=﹣a kJ·mol-1(a>0)
2CO2(g)+N2(g) △H=﹣a kJ·mol-1(a>0)
在一定温度下,将2.0mol NO、2.4mol CO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
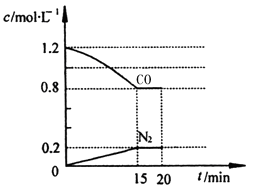
①0~15min N2的平均速率v(N2)= ;NO的转化率为 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是 (选填序号)。
A.缩小容器体积 B.增加CO的量
C.降低温度 D.扩大容器体积
③其它条件不变,按以下选项充入起始物质,各物质体积分数仍然不变的是 。
A.4.0mol NO、4.8mol CO
B.1.0mol NO、1.2mol CO、1.0mol CO2、0.5mol N2
C.1.6mol NO、2.0mol CO、0.4mol CO2、0.2mol N2
D.0.4mol CO、2.0mol CO2、1mol N2
(2)实验室配制FeCl3溶液时,将FeCl3固体溶解在稀盐酸中,请结合离子方程式用平衡移动原理解释原因 。
(3)“氯胺(NH2Cl)消毒法”是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2+NH3=NH2Cl+HCl。NH2Cl能与水反应生成可以杀菌消毒的物质(元素化合价不变)。
①NH2Cl与水反应的化学方程式是 。
②在Cl2+NH3=NH2Cl+HCl中,每消耗0.5mol Cl2,转移电子____________mol。
(每空2分,共10分)铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛。铁还有很多重要的化合物及其化学反应。
如铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H
(1)上述反应的平衡常数表达式K=_____________。
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s) △H1=-1118.4kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H2=-483.8 kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) △H3=-571.8 kJ·mol-1
则△H=_____________。
(3)在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| |
Fe |
H2O(g) |
Fe3O4 |
H2 |
| 甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
| 乙/mol |
1.0 |
1.5 |
1.0 |
1.0 |
①甲容器中H2O的平衡转化率为_____________(结果保留一位小数)。
②下列说法正确的是_____________(填编号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)若将(3)中装置改为恒容绝热(不与外界交换能量)装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
| |
Fe |
H2O(g) |
Fe3O4 |
H2 |
| 起始/mol |
3.0 |
4.0 |
0 |
0 |
| 平衡/mol |
m |
n |
p |
q |
若在达平衡后的装置中继续加入A、B、C三种状况下的各物质,见表:
| |
Fe |
H2O(g) |
Fe3O4 |
H2 |
| A/mol |
3.0 |
4.0 |
0 |
0 |
| B/mol |
0 |
0 |
1 |
4 |
| C/mol |
m |
n |
p |
q |
当上述可逆反应再一次达到平衡状态后,上述各装置中H2的百分含量按由大到小的顺序排列的关系是___________(用A、B、C表示)。