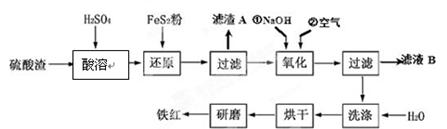
(1)在2L的密闭容器中,由CO2和H2合成甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,
CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,
实验结果如图1所示(注:T2>T1,均大于300℃).
①温度为T2时,从反应开始到平衡,生成甲醇的平均反应速率为 .
②通过分析图1,温度对反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的影响可以概括为 .
CH3OH(g)+H2O(g)的影响可以概括为 .

③下列情形能说明上述反应已达到平衡状态的是 (填字母).
| A.体系压强保持不变 |
| B.密闭容器中CO2、H2、CH3OH(g)、H2O(g)4种气体共存 |
| C.CH3OH与H2物质的量之比为1:3 |
| D.每消耗1mol CO2的同时生成3mol H2 |
④已知H2(g)和CH3OH(l)的燃烧热△H分别为﹣285.8kJ·mol﹣1和﹣726.5kJ·mol﹣1,写出由CO2和H2生成液态甲醇和液态水的热化学方程式: .
(2)在容积可变的密闭容器中,由CO和H2合成甲醇CO(g)+2H2(g) CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图2所示.
CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图2所示.
①该反应的平衡常数表达式K=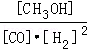 ,250℃、0.5×104 kPa下的平衡常数 (填“>”、“<”或“=”)300℃、1.5×104 kPa下的平衡常数.
,250℃、0.5×104 kPa下的平衡常数 (填“>”、“<”或“=”)300℃、1.5×104 kPa下的平衡常数.
②实际生产中,该反应条件控制在250℃、1.3×104 kPa左右,选择此压强而不选择更高压强的理由是 .
 2CO2(g)+ N2(g) 。在密闭容器中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断:
2CO2(g)+ N2(g) 。在密闭容器中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断: N2O4(g)ΔH12NO2(g)
N2O4(g)ΔH12NO2(g)

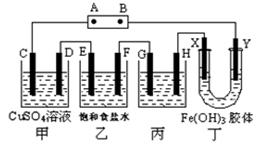
 (3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。 粤公网安备 44130202000953号
粤公网安备 44130202000953号