铁及其化合物在日常生活、生产中应用广泛。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3 + 3NaClO + 4NaOH ="=" 2Na2FeO4 + 3X + 5H2O, 则X的化学式 ,反应中 被氧化。
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下: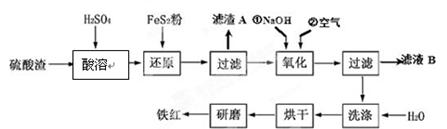
①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为 ;
“滤渣A”主要成份的化学式为 。
②还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2 + 14Fe3 + + H2O ="=" 15Fe2 + + SO42-+ 。
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 。
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.8 |
7.6 |
9.4 |
| 完全沉淀pH |
3.2 |
5.2 |
9.7 |
12.4 |
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,如果pH过大,可能引起的后果是 (几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式) 。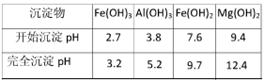


 粤公网安备 44130202000953号
粤公网安备 44130202000953号