50 mL密度为1.84 g·cm-3,质量分数为98%的浓H2SO4,其H2SO4的物质的量浓度为 。若将50 mL该浓H2SO4稀释成密度为1.47 g·cm-3的溶液100mL,需水 mL。(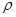 水=1g·cm-1)稀释后溶液的质量分数为 ,物质的量浓度为 。
水=1g·cm-1)稀释后溶液的质量分数为 ,物质的量浓度为 。
50 mL密度为1.84 g·cm-3,质量分数为98%的浓H2SO4,其H2SO4的物质的量浓度为 。若将50 mL该浓H2SO4稀释成密度为1.47 g·cm-3的溶液100mL,需水 mL。(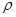 水=1g·cm-1)稀释后溶液的质量分数为 ,物质的量浓度为 。
水=1g·cm-1)稀释后溶液的质量分数为 ,物质的量浓度为 。