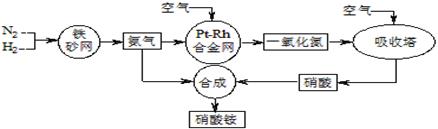
工业生产硝酸铵的流程如下图所示
(1)硝酸铵的水溶液呈 (填“酸性”、“中性”或“碱性”);其水溶液中各离子的浓度大小顺序为: 。
(2)已知N2(g)+3H2(g) 2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如右图。
2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如右图。
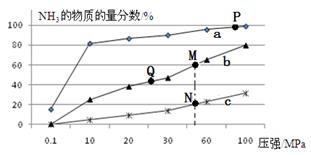
①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是
| A.及时分离出NH3可以提高H2的平衡转化率 |
| B.P点原料气的平衡转化率接近100%,是当前工业生产工艺中采用的温度、压强条件 |
| C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N) |
| D.M点比N点的反应速率快 |
E.如果N点时c(NH3)=0.2 mol·L-1,N点的化学平衡常数K≈0.93
(3)尿素(H2NCONH2)是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为二步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272 kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138 kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式: ;
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下左图所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定,总反应进行到_________min时到达平衡。
②在上右图中画出第二步反应的平衡常数K随温度的变化的示意图。
尿素是蛋白质代谢的产物,也是重要的化学肥料。工业合成尿素反应如下: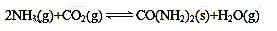
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。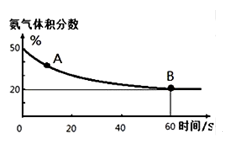
①A点的正反应速率v正(CO2)_______B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为________________________。
②关于上述反应的平衡状态下列说法正确的是________________
| A.分离出少量的尿素,反应物的转化率将增大 |
| B.平衡时再充入一定量NH3 (g),CO2的转化率增大 |
| C.NH3的转化率始终等于CO2的转化率 |
| D.加入有效的催化剂能够提高尿素的产率 |
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(l) (氨基甲酸铵) △H1
H2NCOONH4(l) (氨基甲酸铵) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示: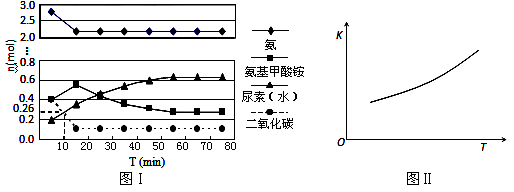
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_______步反应决定,总反应进行到 _______ min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_________ 。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 ________0(填“>”“<”或“=”)
④第一步反应的△S ________0(填“>”、“<”或,“=”),在________(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底。将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素。此时溶液中c(NH4+)= _____________________;NH4+水解平衡常数值为______________。
在一密闭容器中发生反应N2+3H2 2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
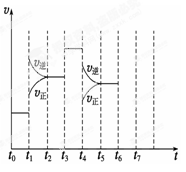
(1)处于平衡状态的时间段是 (填选项)。
A.t0~t1
B.t1~t2
C.t2~t3
D.t3~t4
E.t4~t5
F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是_____(填选项)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.加催化剂
F.充入氮气
t1时刻 ;t3时刻 ;t4时刻 。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 (填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 。
如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1molA、3molB,此时两容器体积均为500mL,温度为T℃。保持温度不变发生反应:A(g)+3B(g)  2C(g)+D(s) ΔH<0
2C(g)+D(s) ΔH<0

(1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是 。
A.混合气体的总质量不随时间改变
B.2 v正(C) = 3v逆(B)
C.A、B转化率相等
D.物质D的质量不随时间改变
(2)2min后甲容器中反应达到平衡,测得C的浓度为2mol/L,此时甲容器的体积为_______mL。
(3)当甲乙两容器中反应都达平衡时,甲和乙中B的转化率α甲(B) _________α乙(B)。(填“>”“<”或“=”)
(4)其它条件不变,甲中如果从逆反应方向开始反应建立平衡,要求平衡时C的物质的量与(2)中平衡时C的物质的量相等,则需要加入C的物质的量n(C)=________mol,加入D的物质的量n(D)应该满足的条件为______________。
CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1) 工业上可利用CO生产乙醇:
2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)="==" H2O(g) ΔH2
CO(g)+H2O(g) CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g) CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g),
下列选项能判断该反应达到平衡状态的依据的有 。
A.2v(H2)= v(CO)
B.CO的消耗速率等于CH3OCH3的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(3)工业可采用CO与H2反应合成再生能源甲醇,反应如下:
CO(g)+ 2H2(g) CH3OH(g)
CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,
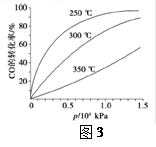
在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。

①合成甲醇的反应为__ (填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为___ 。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为 L。
④(图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图。当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图.
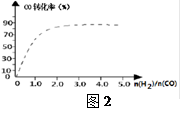
⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图3)所示,实际生产时条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________。
在密闭容器中进行反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1=akJ·mol一1
FeO(s)+CO(g) ΔH1=akJ·mol一1
反应②2CO(g)+O2(g) 2CO2(g) △H2="b" kJ·mol-1
2CO2(g) △H2="b" kJ·mol-1
反应③2Fe(s)+O2(g) 2FeO(s) △H3
2FeO(s) △H3
(1) △H3= (用含a、b的代数式表示)。
(2)反应①的化学平衡常数表达式K= ,已知500℃时反应①的平衡常数K=1.0,在此温度下2 L密闭容器中进行反应①,Fe和CO2的起始量均为2.0 mol,达到平衡时CO2的转化率为 ,CO的平衡浓度为 。
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其他条件不变时,可以采取的措施有 (填序号)。
| A.缩小容器的体积 | B.再通入CO2 |
| C.升高温度 | D.使用合适的催化剂 |
(4)下列图像符合反应①的是 (填序号)(图中V是速率、φ为混合物中CO含量,T为温度)。

在一密闭容器中有如下反应:aX(g)+bY(g) nW(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间。当其它条件不变时,下列分析正确的是
| A.图Ⅰ可能是不同压强对反应的影响,且p2>p1,a+b>n |
| B.图Ⅱ可能是不同压强对反应的影响,且p1>p2,n<a+b |
| C.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好 |
| D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH<0 |
研究氮的氧化物、硫的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物转化为无毒物质。下列说法能说明恒温恒容条件下的反应;2NO(g)+2CO(g)=N2(g)+2CO2(g)△H="-746.5" kJ·mol-1已达到化学平衡的是 。
A.单位时间内消耗了2moINO的同时消耗的2moICO
B.CO与CO2的物质的量浓度相等的状态
C.气体密度保持不变的状态
D.气体平均摩尔质量保持不变的状态
(2)NO2与SO2混合可发生反应:NO2(g)+SO2(g) SO3(g)+NO(g)。
SO3(g)+NO(g)。
将一定量的NO2与SO2置于绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的趋势如图所示。由图(纵轴代表正反应速率)可知下列说法正确的是 (填字母)。

A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.△t1=△t2时,SO2的消耗量:a~b段大于b~c段
(3)CO在实际中有以下应用:用Li2CO3和Na2CO3熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气作为正极助燃气,制得在650℃下工作的燃料电池。完成有关的电极反应式。
负极反应式:2CO+2CO32-一4e-=4CO2 正极反应式: 。
(4)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图:

请回答:①甲烷燃料电池的负极反应式是 。
②当A中消耗0.15 mol氧气时,B中 极(填”a”或”b”)增重__ __g。
一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
4NO2(g)+O2(g)  2N2O5(g)
2N2O5(g)
(1)已知平衡常数K350℃<K300℃,则该反应是_________反应(填“吸热”或“放热”);常温下,该反应能逆向自发进行,原因是_______________________。
(2)下列有关该反应的说法正确的是___________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等。
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是__________。
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝酸溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍 ,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱。按照这个理论,下列微粒属于两性物质的是___________。
a.H2O b.NO2- c.H2NCH2COOH d.H2PO4- e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是___________________________________________(用离子方程式表示)。
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01 mol·L-1的X、Y、Z、W溶液的pH。
| 0.01mol·L-1的溶液 |
X |
Y |
Z |
W |
| pH |
12 |
2 |
8.5 |
4.5 |
将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为 ________________________________________________。
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为 ______________________________。

氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:N2(g)+3H2(g) NH3(g)ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题:
NH3(g)ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题:

(1)计算反应在第一次平衡时的平衡常数K= 。(保留二位小数)
(2)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率(平均反应速率分别以v1、v2、v3表示)从大到小排列次序为 。
(3)H2在三次平衡阶段的平衡转化率分别以α1、α2、α3表示,其中最小的是 。
(4)由第一次平衡到第二次平衡,平衡移动的方向是_______,采取的措施是________。
(5)请在下图中用实线表示25~60min 各阶段化学平衡常数K的变化图像。

向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3时刻为使用催化剂。下列说法中正确的是
A.若t1=15 s,用A的浓度变化表示t0~t1阶段的平均反应速率为0.004 mol·L-1·s-1
B.t4~t5阶段改变的条件一定为减小压强
C.该容器的容积为2 L,B的起始物质的量为0.02 mol
D.t5~t6阶段,若容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式3A(g) B(g)+2C(g)ΔH=-50a kJ·mol-1
B(g)+2C(g)ΔH=-50a kJ·mol-1
Ⅰ.CO可用于合成甲醇。在压强为0.1MPa条件下,在体积为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:
CO(g)+2H2(g) CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
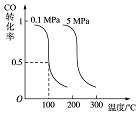
(1)该反应属于 反应(填“吸热”或“放热”)。
(2)100℃时,该反应的平衡常数:K= (用a、b 的代数式表示)。
(3)在温度和容积不变的情况下,再向平衡体系中充入a mol CO,2a mol H2,达到平衡时CO转化率 (填“增大”“不变”或“减小”)
Ⅱ.T ℃时,纯水中c(OH-)为10-6 mol·L-1,则该温度时
(1)将pH=3 的H2SO4溶液与pH=10的NaOH溶液按体积比9:2 混合,所得混合溶液的pH为 。
(2)若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
Ⅲ. 在25mL的氢氧化钠溶液中逐滴加入0.2 mol/ L醋酸溶液,滴定曲线如图所示。

(1)该氢氧化钠溶液浓度为________________。
(2)在B点,a_________12.5 mL(填“<”“>”或“=”)。若由体积相等的氢氧化钠溶液和醋酸溶液混合且恰好呈中性,则混合前c(NaOH) c(CH3COOH)
(3)在D点,溶液中离子浓度大小关系为_____________________。
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)  2B(g)。在三种不同条件下进行实验,A的物质的量随时间的变化如图所示。试回答下列问题:
2B(g)。在三种不同条件下进行实验,A的物质的量随时间的变化如图所示。试回答下列问题:

(1)实验1中,4s时A的转化率为 ;此条件下该反应的平衡常数K1的值为 。
(2)实验2与实验1对比,其可能隐含的反应条件是 。
(3)根据实验3与实验1的图象比较,可推测该反应是 (填“放热”或“吸热”)反应。设实验1~3的平衡常数的值分别为K1、K2、K3,则它们之间的关系为K1 K2 K3(填“>”、“<”或“=”)。
(4)为了验证增大催化剂的表面积、增大压强可提高化学反应速率这一结论,某同学在实验1的基础上又利用该容器设计了实验4和实验5,部分实验条件及数据见下表。请将表格补充完整。
| 实验编号 及其目的 |
V(容积)/L |
t/℃ |
n(A起始)/mol |
n(B起始)/mol |
催化剂的质量/g |
催化剂的表面积/m2·g—1 |
| 实验1参照对比实验 |
2 |
80 |
1.2 |
0 |
a |
b |
| 实验4:催化剂的表面积对反应速率的影响 |
|
|
|
|
|
|
| 实验5目的: |
1 |
|
|
|
|
|
工业生产硝酸铵的流程如下图所示

(1)硝酸铵的水溶液呈 (填“酸性”、“中性”或“碱性”);其水溶液中各离子的浓度大小顺序为: 。
(2)已知N2(g)+3H2(g) 2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。
2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。

①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是
| A.及时分离出NH3可以提高H2的平衡转化率 |
| B.P点原料气的平衡转化率接近100%,是当前工业生产工艺中采用的温度、压强条件 |
| C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N) |
| D.M点对应的H2转化率是75% |
E.如果N点时c(NH3)=0.2 mol·L-1,N点的化学平衡常数K≈0.93
(3)尿素(H2NCONH2)是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为二步反应:第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272 kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138 kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下左图所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第__________步反应决定,总反应进行到________min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_______________mol·L-1·min-1。
③在右图中画出第二步反应的平衡常数K随温度的变化的示意图。
Bodensteins研究了下列反应:2HI(g) H2(g)+I2(g)
H2(g)+I2(g)  。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min |
0 |
20 |
40 |
60 |
80 |
120 |
| x(HI) |
1 |
0.91 |
0.85 |
0.815 |
0.795 |
0.784 |
| x(HI) |
0 |
0.60 |
0.73 |
0.773 |
0.780 |
0.784 |
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当改变条件,再次达到平衡时,下列有关叙述不正确的是
A.若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E
B.若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大
C.若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同
D.若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同