某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。A中试管内盛放的物质是Ca(OH)2、NH4Cl固体。
【实验探究】
(1)A中发生反应的化学方程式为 。
(2)B中盛放的干燥剂为 ,干燥氨气能否用浓硫酸 (填“能”或“不能”)
(3)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是 L
(4)实验室收集氨气的方法是 。
(5)C、D装置中颜色会发生变化的是 (填“C”或“D”),红色石蕊试纸变成 色。
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到的现象是 。
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是 (填“F”或“G”)。
(1)二氧化硫是无色有刺激性气味的有毒气体,它是一种酸性氧化物。在加热条件下,铜与浓硫酸反应能生成二氧化硫,有关化学方程式为:Cu + 2H2SO4(浓)  CuSO4 + SO2↑+ 2H2O,某课外活动小组设计了如图所示实验装置,进行铜与浓硫酸的反应。
CuSO4 + SO2↑+ 2H2O,某课外活动小组设计了如图所示实验装置,进行铜与浓硫酸的反应。
①装置B是二氧化硫气体的收集装置,请在图中补上导气管。
②NaOH溶液的作用是________________________________。
有关反应的离子方程式是:______________________________。
(2)为认识浓H2SO4的强氧化性,老师在B、C、D试剂瓶中依次分装酸性KMnO4溶液、品红溶液、澄清石灰水,进行下图所示的实验。
①你预计反应中浓H2SO4中硫元素的化合价应 (填“升高”或“降低”)
②若B中酸性KMnO4溶液紫色变浅,说明A中反应的生成物之一具有 性。
③老师提醒同学们,如果把B、D顺序对调,即使澄清石灰水变浑浊也不能说明木炭已被氧化成CO2其原因是 : (用化学方程式表示)。
(10分,每空1分)实验室制乙烯的反应原理为CH3CH2OH  CH2===CH2↑+H2O,制取时常因温度过高而发生副反应,使部分乙醇跟浓硫酸反应生成二氧化硫、二氧化碳、水蒸气和炭黑。
CH2===CH2↑+H2O,制取时常因温度过高而发生副反应,使部分乙醇跟浓硫酸反应生成二氧化硫、二氧化碳、水蒸气和炭黑。



(1)请用图中编号为①、②、③、④的装置设计一个实验,以验证上述反应混合气体中含有CO2、SO2和水蒸气。用装置的编号表示装置的连接顺序(按产物气流从左到右):
→ → → 。
(2)实验时装置①中A瓶的现象是 ,原因是 。
B瓶中的现象是 ,B瓶溶液的作用是 。
若C瓶中品红溶液不褪色,说明 。
(3)装置③中加的固体药品是 ,以验证混合气体中有 。装置②中盛的溶液是 ,以验证混合气体中的 。
某化学课外小组用下图装置制取纯净的溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中(A下端活塞关闭)。
(1)写出A中反应的化学方程式 。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是 ,写出有关的化学方程式 。
(3)C中盛放CCl4的作用是 。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,现象是 。
(6分)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室用教材的装置制取乙酸乙酯。回答下列问题:
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是: 。
(2)浓硫酸的作用是:① ;② 。
(3)饱和碳酸钠溶液的主要作用是 。
实验室用下图装置制取少量溴苯,试填写下列空白。
(1)在烧瓶a中装的试剂是铁粉、 和 。(各1分)
(2)请你推测长直导管b的作用: __________
(3)请你分析导管c的下口可否浸没于液面中?为什么? __________
(4)反应完毕后,向锥形瓶d中滴加AgNO3溶液有 生成,此现象说明这种获得溴苯的反应属于: 。(填有机反应类型)(各1分)
化学实验有助于理解化学知识,提升科学素养。某学习小组在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关探究。
(1)已知发生装置如图所示。请写出该反应的离子方程式 。
制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
(2)为了制取纯净干燥的氯气,应将氯气依次通过盛有 , 的试剂瓶(填试剂名称)
(3)该小组关于实验中可制得氯气体积(标准状况)的讨论正确的是 。
A.若提供0.4 mol HCl,MnO2不足量,则可制得氯气2.24 L
B.若提供0.4 mol HCl,MnO2过量,则可制得氯气2.24 L
C.若有0.4 mol HCl参与反应,则可制得氯气2.24 L
D.若有0.4 mol HCl被氧化,则可制得氯气2.24 L
(4)写出工业制氯气的化学方程式
某化学实验小组的同学利用乙醇和浓硫酸制备乙烯气体并验证乙烯的某些化学性质。步骤如下:
①在一蒸馏烧瓶中加入约20mL乙醇和浓硫酸(体积比为1∶3),再加入少量的碎瓷片;
②瓶口插上带温度计的橡皮塞;
③加热并迅速使反应温度上升到170℃;
④气体通过稀NaOH溶液进行洗气后,分别通人酸性KMnO4溶液和溴水中。
据此回答下列问题:
(1)写出实验室制备乙烯的化学方程式: ______ 。
(2)在反应液中加入少量碎瓷片的作用是_________ 。
(3)步骤②中温度计水银球的正确位置是_______________________________ ____。
(4)步骤③加热时,若反应温度不能迅速升高到170℃会产生一种有机副产物,写出该物质的名称_____ 。
(5)将乙烯(除杂后)通人酸性KMnO4溶液中,观察到的现象是 ;通人溴水中发生反应的化学方程式是 。
某化学创新实验小组设计了如图示实验装置来制取溴苯并证明该反应为取代反应。已知:溴苯的熔点为‒30.8℃,沸点156℃。
(1)三颈烧瓶中发生的有机反应化学方程式 ;
(2)仪器A的名称 ;本实验使用仪器A的原因 。而在实验室实际实验时并没有使用A的原因是 。
(3)锥形瓶中小试管内CCl4作用 ;如不加该部分装置将导致什么结果 。
(4)分液漏斗内的NaOH溶液作用: 。
某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质。请回答:
(1)实验室制备氨气的化学方程式为 ;
(2)装置B中烧杯滴加酚酞溶液,并打开止水夹,观察到烧瓶内产生了 ,则说明氨气具有的性质是 , 。
(3)写出氨气与水反应的化学方程式 。
(4)为防止污染空气,以下装置可用于吸收多余氨气的是 。
(16分)(1)下图所示都是实验室中制取气体的装置,其中能实现随开随用,随关随停的是____________,其中仪器B的名称是____________。
(2)请简述检验装置III的气密性的方法_________________________________.
(3)实验室利用铜和浓硫酸制取SO2,可选择上述气体发生装置的_________来实现。请写出其反应的化学方程式___________________________.
(4)若要用浓硫酸(质量分数为98%,密度为1.84g/mL)配制1 mol/L的稀硫酸500mL,则需要量取浓硫酸的体积为__________mL,所需的玻璃仪器有量筒、玻璃棒、烧杯、_________。
(5)①若在100 ml 18 mol/L浓硫酸中加入过最铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是__________________。
| A.40.32 L | B.30.24 L | C.20.16 L | D.13.44 L |
②若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程_ 。
下图是实验室制取、提纯氯气及研究氯气性质的装置图。请回答:
(1)上图实验室制备氯气的化学反应方程式为 。
(2)通常用向上排空气法或者排饱和食盐水法收集氯气,若要利用C瓶收集到干燥纯净的氯气,B瓶所装的试剂是 。(填名称)
(3)若D瓶中装有硝酸银溶液,则观察到的现象是 。
(4)E装置用来 ,写出E装置中发生化学反应的离子方程式 。
某课外学习小组的同学设计了如图的装置,以验证SO2的氧化性、还原性和漂白性(A中长颈漏斗上固定了多孔塑料板,用于放置块状固体)。回答以下问题:
(1)用Na2SO3粉末和硫酸溶液制取SO2气体,应选用_____(选“A”或“C”)做气体发生装置。在确保气密性良好的情况下,小组同学仍发现产生气体的速率缓慢,可能的原因是 (回答出一种即可)
(2)课外学习小组的同学用FeS块状固体和稀硫酸反应制取H2S气体,反应的方程式为 ;
(3)单独使SO2气体通过E装置时的现象是 ;
使SO2与H2S在B装置中混合,现象是_______________________________。
(4)F装置可用盛有 溶液的洗气瓶代替。
(8分)实验室用下列反应制取CO2和CO:H2C2O4 CO2 + CO + H2O,然后用下图所示装置将CO2和CO进行分离和干燥,已知分液漏斗中为稀硫酸,甲瓶中为NaOH溶液。试回答下列各题:
CO2 + CO + H2O,然后用下图所示装置将CO2和CO进行分离和干燥,已知分液漏斗中为稀硫酸,甲瓶中为NaOH溶液。试回答下列各题:
(1)乙瓶中装的是 ;
(2)关闭分液漏斗活塞a,打开b,通入混合气体,在右端收集到的气体是 ,甲中反应的离子方程式为 ;
(3)通入气体结束后,得到另一种气体的方法是:关闭活塞 (填写a或b,下空同)打开 ,在右端收集气体,此时甲中反应的离子方程式为 。
下图是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(AgNO3溶液)、C(氯化亚铁溶液)、D(石蕊试液)、E(浓硫酸)、H(NaOH溶液)。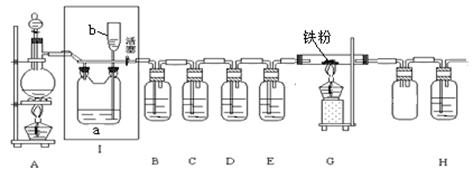
回答下列问题:
(1)A为氯气发生装置,圆底烧瓶中盛放MnO2,分液漏斗中盛放浓盐酸。反应的化学方程式是 。
(2)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃G处酒精灯。装置B中的现象是 ;装置D中的现象是 ;
C中反应的化学方程式是 ;G中反应的化学方程式是 。
(3)G处反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,此时应该怎样操作 ;装置Ⅰ中的现象是 。
(4)热的氯气进入H溶液中,不但有NaClO生成,还有NaClO3生成。若n(NaClO)︰n(NaClO3)﹦1︰2,则氧化剂与还原剂的物质的量比为 。