下图是实验室制取、提纯氯气及研究氯气性质的装置图。请回答: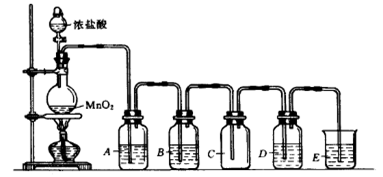
(1)上图实验室制备氯气的化学反应方程式为 。
(2)通常用向上排空气法或者排饱和食盐水法收集氯气,若要利用C瓶收集到干燥纯净的氯气,B瓶所装的试剂是 。(填名称)
(3)若D瓶中装有硝酸银溶液,则观察到的现象是 。
(4)E装置用来 ,写出E装置中发生化学反应的离子方程式 。
下图是实验室制取、提纯氯气及研究氯气性质的装置图。请回答:
(1)上图实验室制备氯气的化学反应方程式为 。
(2)通常用向上排空气法或者排饱和食盐水法收集氯气,若要利用C瓶收集到干燥纯净的氯气,B瓶所装的试剂是 。(填名称)
(3)若D瓶中装有硝酸银溶液,则观察到的现象是 。
(4)E装置用来 ,写出E装置中发生化学反应的离子方程式 。