(12分)过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
Ⅰ.过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下:

(1)用上述方法制取CaO2·8H2O的化学方程式是 。
(2)沉淀时常用冰水控制温度在10℃以下,其可能原因分别是 。
Ⅱ.过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200 mol·L—1KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+ =2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为 。
(4)根据表1数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)
| 滴定次数 |
样品的质量/g |
KMnO4溶液的体积/mL |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
0.3000 |
1.02 |
24.04 |
| 2 |
0.3000 |
2.00 |
25.03 |
| 3 |
0.3000 |
0.20 |
23.24 |
(共13分)从固体混合物A出发可以发生如下框图所示的一系列变化:

(1)在实验室中常用反应①制取气体C。若要收集气体C,可选择下图装置中的 (填字母)
(2)操作②的名称是 ,在操作②中所使用的玻璃仪器的名称是 。
(3)写出下列反应的方程式:反应①的化学方程式
反应③的化学方程式
(4)在实验室中,要获得干燥纯净的黄绿色气体F,可以将它通过下图中的装置,
其中瓶I中盛放的是 ,瓶II中盛放的是 。
(5)实验中必须吸收多余的气体,以免污染空气。下图是实验室NaOH溶液吸收气体F的装置,为防止发生倒吸现象,合理的装置是 (填选项字母)
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是 +
+ ClO3-+
ClO3-+ =
= MnO2↓+
MnO2↓+ Cl2↑+
Cl2↑+ 。
。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 、 、 ,已知蒸发得到的固体中有NaClO3和NaOH,则一定还含有 (写化学式)。
(4)若粗MnO2样品的质量为12.69 g,第①步反应后,经过滤得到8.7 g MnO2,并收集到0.224 L CO2(标准状况下),则在第②步反应中至少需要 mol NaClO3。
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:

根据题意回答下列问题:
(1)实验中需用1 mol·L-1的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有 。
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式: 。
(3)在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为: 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法 。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明主要操作步骤 、 。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为 。
已知A、B、C、D为气体,其中A为黄绿色,D极易溶于水,形成的溶液可
使酚酞变红,它们之间的转化关系如下图①所示:
(1)将气体B点燃,把导管伸入盛满气体A的集气瓶,反应过程中的实验现象有 (填序号)
①放热 ②黄绿色褪去 ③瓶口有白雾 ④瓶口有白烟
⑤安静燃烧,发出黄色火焰 ⑥安静燃烧,发出苍白色火焰
(2)实验室制D的化学方程式为 。
(3)实验室可用如上图②所示装置收集D,下列叙述正确的是 (填序号)。
①D气体不能用排水法收集
②干燥管里盛有碱石灰
③图②中的a为棉花团,其作用是防止氨气逸出
(4)气体D催化氧化的化学方程式为 。
(5)物质E的化学式是 ;E在下列物质分类中所属的物质种类是 (填序号)。
①电解质;②化合物;③混合物;④纯净物;⑤非电解质;⑥盐
某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| pH |
5.2 |
3.2 |
9.7 |
9.2 |
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、蒸发皿外还需要的主要仪器为 。
(2)“碱浸”过程中发生的离子方程式是 。
(3)“酸浸”时所加入的酸是 (填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是 。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是: 。
(5)“调pH为2~3”的目的是 。
(6)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是 __。
日常生活中使用的铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下:
一些氢氧化物沉淀的pH如下表:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
| 开始沉淀pH(离子初始浓度0.01 mol/L) |
4 |
2.3 |
10.4 |
| 完全沉淀pH(离子浓度<10-5 mol/L) |
5.2 |
4.1 |
12.4 |
请回答下列问题:
(1)加入盐酸时,氧化铝发生反应的离子方程式为________________。
(2)实验室进行步骤②③④的操作名称为________。
(3)固体A的化学式为________,物质C的化学式为________;溶液中的Na+、Ca2+、Mg2+是在步骤________中分离出去的。
(4)步骤③调节pH的数值范围为________,步骤④调节pH的数值范围为________。
(5)步骤⑥反应的化学方程式为________。
湿法炼锌的冶炼过程可用如图简略表示:

请回答下列问题:
(1)NH3的空间构型是 .氨气易液化,液氨常做制冷剂,氨气易液化的原因是_____________________.
(2)已知ZnO属于两性氧化物,写出ZnO与NaOH溶液反应的化学方程式: .
(3)上述电解过程中析出锌的电极反应式为 .
(4)产生的SO2可用Ba(NO3)2溶液吸收,部分产物可作为工业原料,其反应的离子方程式为
(5)氨是最重要的化工产品之一。合成氨用的氢气可以甲烷为原料制得:
CH4(g)+H2O(g) CO(g)+3H2(g)。有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为_______________________.
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为_______________________.



某合作学习小组的同学拟用硼砂制取硼酸并测定硼酸样品的纯度。制备硼酸的实验流程如下: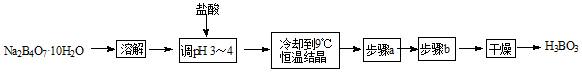
(1)溶解硼砂时需要的玻璃仪器有:烧杯和 。
(2)用pH试纸测定溶液pH的操作方法为 。
(3)用盐酸酸化硼砂溶液生成硼酸的离子方程式为 。
(4)实验流程中缺少的步骤a、步骤b操作分别为 、 。
(5)硼酸酸性太弱不能用碱的标准溶液直接滴定,实验室常采用间接滴定法,其原理为: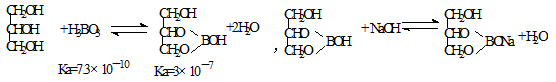
滴定步骤为:
①定到终点时溶液颜色变化是 。
②若滴定到终点时消耗NaOH标准溶液22.00mL,则本次滴定测得的硼酸样品中硼酸的质量分数为 (假定杂质不反应)。
③若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,将导致测得的结果 (选填:“偏大”、“偏小”或“不变”)。
利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:
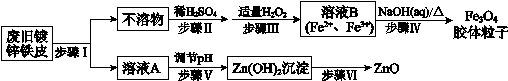
已知:Zn及其化合物的性质与Al及其化合物的性质相似。
回答下列问题:
(1)步骤I中所用的试剂是___________。
(2)步骤III中反应的离子方程式是__________________________________。
(3)步骤V可选用的试剂是_________(填序号)。
a.NaOH溶液 b.氨水 c.盐酸
(4)步骤VI的实验操作是_____________。
已知孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeO、SiO2。现以孔雀石为原料制备CuSO4·5H2O。
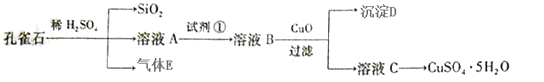
(1)实验步骤中试剂①最佳选择 (填代号);
a.H2O2 b.Cl2 c.KMnO4 d.HNO3
请写出其对应的离子方程式 。
(2)溶液B中加入CuO作用是 。
(3)由溶液C获得CuSO4·5H2O晶体,需要经___________、____________和过滤。
(4)25 ℃,Fe(OH)3的Ksp=1×10-38,若要将溶液中的Fe3+沉淀完全,必需调节溶液pH> 。
(5)实验室用惰性电极电解500ml的CuSO4溶液一段时间后,撤去电源,若加入0.2mol Cu(OH)2恰好使电解液恢复到原来状态,则电解过程中转移电子的物质的量为__________mol,原CuSO4溶液的物质的量浓度为________mol·L-1。
铁及其化合物有重要用途,如聚合硫酸铁[]是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品: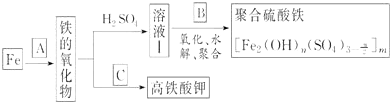
请回答下列问题:
(1)若A为H2O(g),写出反应方程式___________________________;
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-)_________________;
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸钾(K2FeO4)的化学方程式,并配平:
□Fe2O3+□KNO3+□KOH→□ ________ +□KNO2+□ ______
(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol・L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2; I2+2S2O32-═2I-+S4O42-
①滴定选用的指示剂及滴定终点观察到的现象__________________________;
②溶液Ⅰ中铁元素的总含量为__________ g・L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会________(填“偏高”“偏低”或“不变”)。
(14分)尿素可作为H2O2的稳定载体,生产一种固态、耐储存、易运输的新型氧化剂和消毒剂—过氧化尿素[CO(NH2)2·H2O2],其合成工艺流程如下:
请回答下列问题:
(1)操作I、II的名称分别是________、_________。CO(NH2)2·H2O2分子中尿素和过氧化氢之间以________结合,其结合力较弱,具有尿素和过氧化氢双重性质。

(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3kJ/mol、285.8kJ/mol
②H2O(l)=H2O(g) H =+44.0kJ/mol
写出CH4与水蒸气作用生产CO2和H2的热化学方程式: 。
(3)为测定产品中H2O2的含量,称取干燥样品12.0g配成250mL溶液,取25.00mL
于锥形瓶中,加入适量硫酸酸化,用0.20mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL.(KMnO4溶液与尿素不反应).
①完成并配平方程式:

②计算出产品中H2O2的质量分数为_____________。
(4)电解含尿素的废水既可以处理废水,又可制得纯氢,电解原理如图所示。电解池中隔膜仅阻止气体通过,A、B两极均为惰性电极。请写出阳极的电极反应方程为_____________。

(15分)电子垃圾含70%Cu、25%Al、4%Fe以及少量Pt、Au)实验室现欲回收处理制备硫酸铜和硫酸铝晶体,合成路线如下
查阅资料获取下列信息Cu可与H2SO4、H2O2反应生成CuSO4;铁铝铜等离子沉淀为氢氧化物的PH值如表所示
请回答下列问题
(1)写出Cu与稀H2SO4、H2O2反应的离子方程式 ;
(2)操作Ⅱ中X的取值范围 ;
(3)操作Ⅲ中蒸发浓缩所需的玻璃仪器 ;
(4)操作中的滤渣生成Al2(SO4)3·18H2O的化学方程式 ;
(5)为测定CuSO4 ·5H2O晶体的纯度,取ag试样配成100ml溶液,取25.00ml,消除干扰离子后,用 b mol.L-1EDTA(Na2H2Y)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+)滴定至终点平均消耗EDTA12.00ml,则CuSO4·5H2O的纯度为 。
高氯酸铵可用于火箭推进剂,实验室可由NaClO3等原料制取(部分物质溶解度如图),其实验流程如下:

(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为 。
(2)80℃时浸取液冷却至0℃过滤,滤渣的主要成分为: (写化学式)。
(3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为 。
(4)已知:2NH4ClO4  N2↑+ 2O2↑ + Cl2↑ +4H2O,现可提供
N2↑+ 2O2↑ + Cl2↑ +4H2O,现可提供
下列试剂:a 饱和食盐水 b 浓H2SO4 c NaOH溶液 d Mg e Cu f Fe
利用下图装置对高氯酸铵热分解产生的三种气体进行分别吸收或收集。
①E中收集到的气体可能是 (填化学式) 。
②A、B、C中盛放的药品依次可以是 (选填:Ⅰ、Ⅱ、Ⅲ)。
Ⅰ. a b d Ⅱ. c b e Ⅲ. b c f