制备多晶硅(硅单质的一种)的副产物以SiCl4为主,其对环境污染很大,遇水强烈水解,放出大量热量。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,含有钙、铁、镁等离子)制备BaCl2·2H2O,流程为:
已知常温下Fe3+、Mg2+完全沉淀的pH分别是3.4和12.4;
(1)①SiCl4水解控制在40℃以下的原因是 。
②已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g) ΔH1=47 kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g) ΔH2=189 kJ/mol
则SiCl4被H2还原制备硅的热化学方程式 。
(2)加钡矿粉时生成BaCl2的离子反应方程式 。
(3)过滤②的滤渣A的成分化学式为 ;接着往滤液中加20% NaOH调节pH=12.5,控制温度70℃时,滤渣B的主要成分的化学式 ,控制温度70℃的目的 。
(4)滤液③经 、过滤等操作,再经真空干燥后得到BaCl2·2H2O。
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6—2x]溶液,并用于烟气脱硫研究。
(1)酸浸时反应的化学方程式为 ;滤渣Ⅰ的主要成分为 (填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6—2x。滤渣Ⅱ的主要成分为 (填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因
是 (用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是 ;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将 (填“增大”、“减小”或“不变”)。
(NH4)2Fe(SO4)2俗称莫尔盐,其常见的制备工艺流程如下: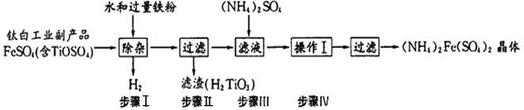
(1)已知流程中铁粉制备反应如下:
4 H2O(g) +3Fe(s) Fe3O4(s)十4H2(g) △H ="a" kJ /mol
Fe3O4(s)十4H2(g) △H ="a" kJ /mol
Fe3O4(s) =" 3" Fe(s)+ 2O2(g) △H ="b" kJ/mol
则光解气态水制备H2的热化学方程式为 。
(2)步骤I中加水发生如下反应,请完善该反应: +2H2O  2H++ H2TiO3 ↓;
2H++ H2TiO3 ↓;
该步骤加入铁粉的作用是① ;② 。
(3)步骤Ⅳ生成(NH4)2Fe(SO4)2,其化学反应方程式为 ;
写出(NH4)2Fe(SO4)2溶液中各离子溶度由大到小的顺序:
(4)已知在潮湿空气中Fe(OH)2比FeCl2更易被氧化。据此分析(NH4)2Fe(SO4)2比FeSO4稳定的原因是 。
(5)室温时Fe(OH)3的悬浊液中存在Fe(OH)3(s) Fe3+(aq)+3OH-(aq) Ksp[Fe(OH)3] =8ⅹ10-32若此悬浊液中 c(Fe3+)="0.08" mol·L-1则溶液的pH等于 。
Fe3+(aq)+3OH-(aq) Ksp[Fe(OH)3] =8ⅹ10-32若此悬浊液中 c(Fe3+)="0.08" mol·L-1则溶液的pH等于 。
(16分)用芒硝(Na2SO4·10H2O)制备纯碱、铵明矾[NH4Al(SO4)2·12H2O]的生产工艺流程图如下所示:
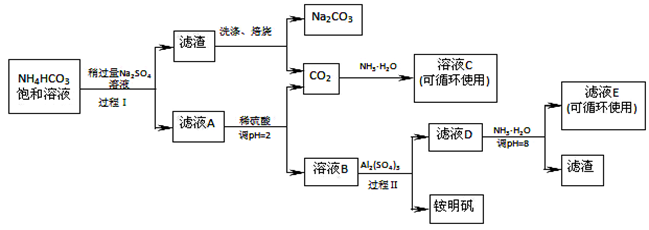
(1)溶液C中的溶质主要是 。
(2)铵明矾的溶液呈 性,铵明矾可用于净水,用离子方程式说明原理 。
(3)过程Ⅰ反应温度不能超过40℃,主要原因是 。
(4)运用化学平衡原理解释Na2SO4溶液稍过量的原因
(5)滤液E中溶质离子为
(6)写出工艺流程中焙烧的反应方程式
用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备难溶于水的碱式碳酸铜的流程如下:
(1)下列措施是为加快浸取速率,无法达到目的的是__ __
| A.延长浸取时间 | B.将辉铜矿粉碎 |
| C.充分搅拌 | D.适当增加硫酸浓度 |
(2)浸取反应中氧化剂的化学式为 ;滤渣Ⅰ的成分为MnO2、S和 (写化学式);
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是 。
(4)“除铁”的方法是通过调节溶液PH,使Fe3+水解转化为Fe(OH)3,加入的试剂A可以是_____(化学式);“赶氨”时,最适宜的操作方法 。
(5)“沉锰”(除Mn2+)过程中反应的离子方程式____________ ____ _______ ___。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是 (写化学式)。
按要求完成下列问题:
(1)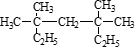 系统命名法为____________________ ,
系统命名法为____________________ ,
(2)4―甲基―1―戊烯的键线式为 __________________________ ,
(3)写出乙醛与新制氢氧化铜反应化学方程式 ____________________________________,
(4)下列有关实验的说法不正确的是_____________。
| A.制乙烯时,温度计应插入反应混合液中 |
| B.检验C2H5Cl中氯元素时,将C2H5Cl和NaOH水溶液混合加热,然后用稀硫酸酸化,再加入AgNO3溶液 |
| C.做过银镜反应的试管用氨水洗涤,做过苯酚的试管用酒精洗涤 |
| D.将一定量CuSO4和NaOH溶液混合后加入甲醛溶液,加热未产生砖红色沉淀,原因可能是NaOH量太少 |
某煤渣主要含有Al2O3、SiO2,可制备碱式硫酸铝[Al2(SO4)3·2Al(OH)3]溶液,用于烟气脱硫,减少SO2的排放,其制备流程:
已知:25℃,Ksp(CaCO3)=2.8×10-9, Ksp(CaSO4)=9.1×10-6。
(1)操作①的名称 。
(2)酸浸时反应的离子方程式为 ;为了提高酸浸时铝元素的浸出率,可采取的措施____________________,___________________(写2条)。
(3)固体2的化学式是 ,试分析固体2生成的主要原因(用离子方程式结合文字简要说明) 。
(4)碱式硫酸铝溶液吸收SO2生成Al2(SO4)3·Al2(SO3)3,再向该溶液通入足量空气,生成一种硫酸盐,用于制备碱式硫酸铝溶液的循环使用,试写出有关反应的化学方程式: , 。
(原创)三聚氰胺(化学式:C3N6H6)是一种重要有机化工原料。下图是我国科技工作者研制的以尿素为原料生产三聚氰胺的工艺——“常压气相一步法联产纯碱新技术”: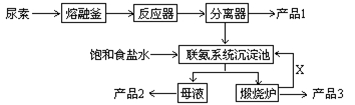
已知:以尿素为原料生产三聚氰胺的原理是:6 CO(NH2)2 C3N6H6 +6 NH3+3CO2
C3N6H6 +6 NH3+3CO2
请回答:
(1)尿素的结构式为
(2)已知:产品1是本工艺的主产品,产品2是副产品,X为循环使用的物质,产品3为纯碱。写出各主要成份的化学式:产品1 产品2 X
(3)联氨系统沉淀池中发生的化学反应方程式为:
(4)为了使母液中析出更多的产品2 ,常用的方法是
| A.加入固体NaCl | B.加入固体NaHCO3 |
| C.通入CO2气体 | D.通入NH3 |
(5)若生产过程中有4%的尿素损耗,每吨尿素理论上可得副产品纯碱 吨(精确到0.001)
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下: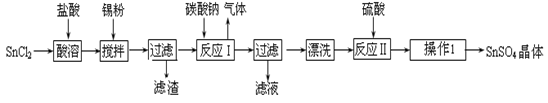
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡, Sn相对原子质量为119
回答下列问题:
(1)锡原子的核电荷数为50,锡元素在周期表中的位置是 。
(2)操作Ⅰ是 。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(4)加入Sn粉的作用有两个:①调节溶液pH ② 。
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl===SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl ===6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.226 g锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0ml。锡粉中锡的质量分数是 。
由钛铁矿(主要成分是TiO2、少量FeO和Fe2O3)制备TiCl4、绿矾等产品的一种综合工艺流程图如下: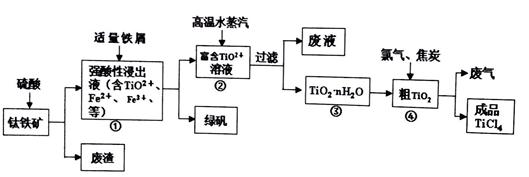
【提示】TiO2+的水解平衡TiO2++(n+1)H2O TiO2.n H2O+2H+
TiO2.n H2O+2H+
回答下列问题:
(1)硫酸与二氧化钛反应的离子方程式是 。
(2)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH =+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH =-221kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
(3)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生。
A:2Fe3++Fe=3Fe2+
B:2 TiO2+(无色) +Fe+4H+=2Ti3+(紫色)+ Fe2++2H2O
C:Ti3+(紫色)+ Fe3++H2O=TiO2+(无色) +Fe2++2H+
I.结合信息判断Fe3+、TiO2+、 H+氧化性强弱: > >
II.加入铁屑的作用是 。
(4)往②中不断通入高温水蒸气,维持溶液沸腾一段时间,析出水合二氧化钛沉淀。
请用化学平衡理论分析通入高温水蒸气的作用: 。
(5)依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)绿矾(摩尔质量为278g/mol)可用于生产红色颜料(Fe2O3),556akg绿矾,理论上可生产红色颜料___mol。
I.下列说法中正确的是_________。
A.制作航天服的聚脂纤维是新型无机非金属材料
B.肥皂可以用来去油污
C.金属的腐蚀属于物理变化
D.煤的气化属于化学变化
II.如图是找国科技工作者研制的以尿素为原料生产三聚氰胺(C3N6H6)的工艺——“常压气相一步法联产纯玻新技术”:
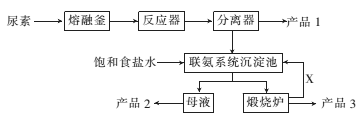
已知:①尿素的熔点是132.7℃ ,常压下超过160℃即可分解;②三聚氰胺的熔点是354℃,加热易升华,微溶于水。
请回答下列问题:
(1)以尿素为原料生产三聚氮胺的原理:____CO(NH2)2 ______C3N6H6+___NH3↑+__CO2↑
______C3N6H6+___NH3↑+__CO2↑
(配平化学方程式,在横线上填上相应物质的化学计量数),在实验室使尿素熔化的容器的名称为________。
(2)写出下列物质中主要成分的化学式:产品2_____、X_____ 。
(3)联氨系统沉淀池中发生反应的化学方程式为____________。
(4)为了使母液中析出更多的产品2,常用的方法是________。
A.加人NaOH固体 B.加入NaHCO3固体 C.通人CO2 D.通入NH3
锂被誉为“金属味精”,以 LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以 β-锂辉矿(主要成分为 LiAlSi2O6,还含有 FeO、MgO、CaO 等杂质)为原料来制 取金属锂。其中一种工艺流程如下:
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的 pH:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.7 |
9.6 |
| 完全沉淀pH |
3.7 |
4.7 |
11 |
②Li2CO3在不同温度下的溶解度如下表:
| 温度/℃ |
0 |
10 |
20 |
50 |
75 |
100 |
| Li2CO3的溶解度/g |
1.539 |
1.406 |
1.329 |
1.181 |
0.866 |
0.728 |
请回答下列问题:
(1)用氧化物形式表示 LiAlSi2O6的组成
(2)反应Ⅱ加入碳酸钙的作用是
(3)写出反应Ⅲ中生成沉淀 A 的离子方程式
(4)反应Ⅳ生成 Li2CO3 沉淀,写出在实验室中得到 Li2CO3沉淀的操作名称 , 洗涤所得 Li2CO3 沉淀要使用 ( 选填“热水”或“冷水”) ,你选择的理由是
(5 )电解熔融氯化锂生产 锂时,阳极产生的氯气中 会混有少量氧气,原因是
硼氢化钠()在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备
,其流程如下:
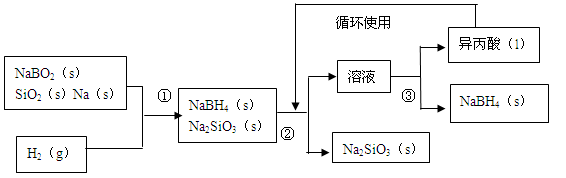
已知:常温下能与水反应,可溶于异丙酸(沸点:13℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是,原料中的金属钠通常保存在中,实验室取用少量金属钠需要用到的实验用品有,,玻璃片和小刀等。
(2)请配平第①步反应的化学方程式:
+□
+□
+□
==□
+□
(3)第②步分离采用的方法是;第③步分离()并回收溶剂,采用的方法是。
(4)与水反应生成
和氢气,在25℃,101
下,已知每消耗3.8克
放热21.6
,该反应的热化学方程式是。
硝酸铝[Al(NO3)3]是一种常用媒染剂。工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3·9H2O]的流程如下: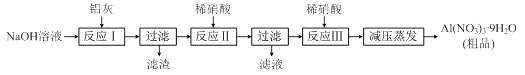
(1)写出反应Ⅰ的离子方程式: (任写一个)。
(2)若在实验室中完成反应Ⅱ,为避免铝的损失,需要解决的问题是 ,可采取的措施为 。
(3)上述流程中采用减压蒸发,并控制反应Ⅲ中加入的稀硝酸稍过量,其目的是 。
(4)温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4:1),该反应的化学方程式是 。
(5)若用下图所示实验装置制取Al(NO3)3,通入水蒸气的作用是 。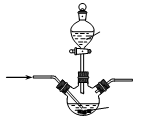
用磷灰石制磷肥的副产品六氟硅酸钠(Na2SiF6)可制冰晶石(Na3AlF6),冰晶石是电解铝的助熔剂,可降低氧化铝的熔点。下图是工业制铝的流程图:
(1)工业上从铝土矿制备较高纯度Al2O3的主要工艺流程需__________个环节,第一步反应的方程式______________________________________________________________
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是________溶液,滤渣是________ 。
(3)分解脱硅和合成冰晶石化学反应方程式分别为:_________________、____________________。
(4)工艺过程中③和④的目的是_____________________,碳酸钠和二氧化碳是否够用 。
(5)电解Al2O3制Al时,I=200kA,一天制Al 1.430 t,电解效率是多少?