利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:
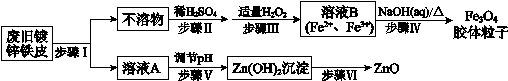
已知:Zn及其化合物的性质与Al及其化合物的性质相似。
回答下列问题:
(1)步骤I中所用的试剂是___________。
(2)步骤III中反应的离子方程式是__________________________________。
(3)步骤V可选用的试剂是_________(填序号)。
a.NaOH溶液 b.氨水 c.盐酸
(4)步骤VI的实验操作是_____________。
现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
已知反应I为:NaCl + CO2 + NH3 + H2O === NaHCO3↓+ NH4Cl
(1)工业生产中,制备NH3的化学方程式是_____________________________。
(2)海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO42−等离子。
① 为得到纯净的饱和NaCl溶液,进行了如下操作。请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中___________________________,过滤;
c.向滤液中___________________________,过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液。
② 步骤c中反应的离子方程式是______________________________。
(3)反应II的化学方程式是_________________________________。
(4)制得的纯碱中含有少量NaCl。取5.5 g纯碱样品加入足量稀硫酸,得到标准状况下1120 mL CO2。则样品中纯碱的质量分数是_________%(保留1位小数)。
已知孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeO、SiO2。现以孔雀石为原料制备CuSO4·5H2O。
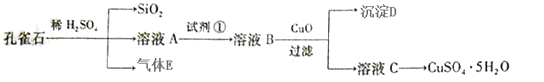
(1)实验步骤中试剂①最佳选择 (填代号);
a.H2O2 b.Cl2 c.KMnO4 d.HNO3
请写出其对应的离子方程式 。
(2)溶液B中加入CuO作用是 。
(3)由溶液C获得CuSO4·5H2O晶体,需要经___________、____________和过滤。
(4)25 ℃,Fe(OH)3的Ksp=1×10-38,若要将溶液中的Fe3+沉淀完全,必需调节溶液pH> 。
(5)实验室用惰性电极电解500ml的CuSO4溶液一段时间后,撤去电源,若加入0.2mol Cu(OH)2恰好使电解液恢复到原来状态,则电解过程中转移电子的物质的量为__________mol,原CuSO4溶液的物质的量浓度为________mol·L-1。
氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl是白色固体,难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以硫化铜精矿为原料生产CuCl的工艺过程如下:
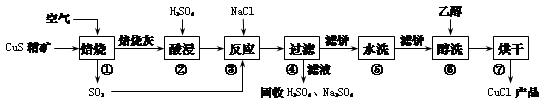
回答下列问题:
(1)CuS精矿经250 ℃低温焙烧后生成CuO,步骤②中主要反应的离子方程式是 。
(2)步骤③先加NaCl、通入SO2时无沉淀,加水稀释就产生大量白色沉淀,其原因是 。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_______(写名称);步骤⑥醇洗的作用是 。
(4)已知25℃,101 kPa时:S(s)+O2(g)==SO2(g) ∆H=-296.8 kJ/mol
2Cu(s)+O2(g)==2CuO(s) ∆H=-314.6 kJ/mol
Cu(s)+S(s)==CuS(s) ∆H=-53.1 kJ/mol
步骤①中CuS与O2反应的热化学方程式是 。
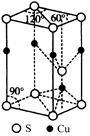
(5)CuS晶胞结构如图所示,其中含有硫原子的数目是 。
(6)假设上述①~③步反应完全转化,④~⑦步操作共损失产品3.5%,反应生成的硫酸全部被循环利用,则生产100 kg 96.5%的CuCl(Mr=99.0)产品,除循环利用之外,需要处理的尾气中含SO2 m3(标准状况)。
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
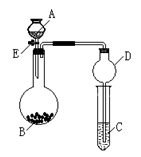
(1)若A为水,B为过氧化钠,C中盛有稀硫酸和FeCl2混合溶液,旋开 活塞E后,C中溶液颜色变化为 ,烧瓶中发生反应的化学方程式为 。
(2)若A为盐酸、B为大理石(主要成分为CaCO3粉末)、C中盛有水玻璃,则小试管中的现象是 ,固体的主要成分为(写化学式)_________________。
(3)利用上述装置可以验证SO2的性质, 若A为浓硫酸,B为亚硫酸钠粉末,那么C中盛有 溶液时可验证其具有漂白性;而C中盛有 溶液时可验证其具有还原性(各填一种物质名称)。
明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
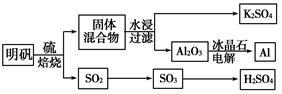
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S 2K2SO4+2Al2O3+9SO2↑+48H2O
2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是 。
(2)从水浸后的滤液中得到K2SO4晶体的方法是 。
(3)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
铁及其化合物有重要用途,如聚合硫酸铁[]是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品: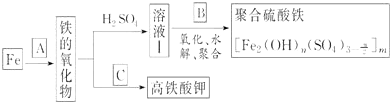
请回答下列问题:
(1)若A为H2O(g),写出反应方程式___________________________;
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-)_________________;
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸钾(K2FeO4)的化学方程式,并配平:
□Fe2O3+□KNO3+□KOH→□ ________ +□KNO2+□ ______
(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol・L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2; I2+2S2O32-═2I-+S4O42-
①滴定选用的指示剂及滴定终点观察到的现象__________________________;
②溶液Ⅰ中铁元素的总含量为__________ g・L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会________(填“偏高”“偏低”或“不变”)。
铜及其化合物在工农业生产及日常生活中应用非常广泛。某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2·2H2O)的流程如下:

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| 金属离子 |
Fe3+ |
Cu2+ |
| 氢氧化物开始沉淀时的pH |
1.9 |
4.7 |
| 氢氧化物完全沉淀时的pH |
3.2 |
6.7 |
请回答下列问题:
(1)溶液Ⅰ中加入试剂X可以调节溶液pH,从而除去Fe3+且不引人杂质
①试剂X选用下列物质中的_______(填代号)。
a.NaOH b.CuO c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是____________________________。
(2)检验溶液Ⅰ中的存在Fe3+实验操作是_____________________。
(3)向溶液Ⅱ中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因________________;
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不参与反应),实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2Cu↓+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为VmL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为___________;
②达到滴定终点时,仰视滴定管读数将使测定结果__________(填“偏高”“偏低”或“无影响”)
③该样品中的质量分数为__________(用含m,c,V的代数式表示,不用化简)。
(5)在空气中由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是________________。
硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O.利用硼镁矿制取金属镁及粗硼的工艺流程如下.
回答下列有关问题:
(1)硼砂中B的化合价为_________,溶于热水后,常用H2SO4调pH到2~3制取H3BO3,反应的离子方程式为________。
(2)X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为________,MgCl2•7H2O脱水需要在HCl氛围中加热,其目的是________。
(3)硼氢化钠是一种常用的还原剂,它与水反应的离子方程式是BH4-+2H2O=BO2-+4H2↑。硼氢化钠在溶液中能把许多金属离子还原为金属单质,为了抑制它与水的反应,反应应在_______(填“酸性”“中性”或“碱性”)条件下进行,试完成并配平金离子(Au3+)被硼氢化钠还原的离子方程式:
_____Au3++____BH4-+_____OH-═___Au↓+______BO2-+____ ______。
MnO2是具有多种特殊功能的材料,工业上用菱铁矿(MnCO3)为原料制备MnO2的工业流程如下:
试回答以下问题:
(1)提高水浸效率的方法有______、______(填两种)。实验室里洗涤MnO2时用到的玻璃仪器有_____。NaClO的电子式为_________。
(2)反应①的化学方程式为___________。
(3)反应②生成MnO2的同时,得到一种黄绿色的气体,则该反应的离子方程式为__________。
(4)反应②的尾气常温下通入NaOH溶液后,生成NaClO可循环利用,若制得87gMnO2,理论上还需要补充NaClO______mol。
(5)工业上还可以将菱锰矿用硫酸直接浸取后,通过电解MnSO4和H2SO4的混合液制备MnO2,则电解时阳极的电极反应式为__________。
硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:
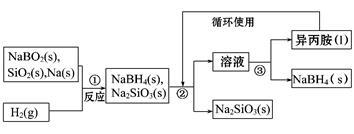
已知:NaBH4常温下能与水反应,可溶于异丙胺(沸点:33℃)。
(1)NaBH4中H元素的化合价为 。
请配平第①步反应的化学方程式,并用单线桥标出电子转移的方向和数目:
□NaBO2+□SiO2+□Na+□H2 □NaBH4+□Na2SiO3
□NaBH4+□Na2SiO3
(2) 实验室取用少量金属钠需要用到的实验用品有 、滤纸、玻璃片和小刀等。
在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是 。
(3)第②步分离采用的方法是 。
第③步分出NaBH4并回收溶剂,采用的方法是 。
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和氢气(g),在25℃,101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是 。
CMA(醋酸钙、醋酸镁固体的混合物)是高速公路的绿色融雪剂。以生物质废液——木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)及白云石(主要成分MgCO3·CaCO3,含SiO2等杂质)等为原料生产CMA的实验流程如下:

(1)步骤①发生的反应离子方程式为 。
(2)步骤②所得滤渣1的主要成分为 (写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是 。
(3)已知CMA中钙、镁的物质的量之比与出水率(与融雪效果成正比)关系如右图所示,步骤④的目的除调节n(Ca)∶n(Mg)约为 (选填: 1∶2;3∶7;2∶3)外,另一目的是 。

(4)步骤⑥包含的操作有 、过滤、洗涤及干燥。
(16分) Ⅰ请回答:
(1)CO2的电子式____________________
(2)钠燃烧不能用CO2灭火,用化学方程式表示其理由________________
(3)重晶石(BaSO4)不溶于酸,用饱和Na2CO3处理转化为易溶于酸的BaCO3,写出反应的离子方程式__________________
Ⅱ。化合物K3Fe(A2B4)3.3H2O 是重要的催化剂。将化合物K3Fe(A2B4)3.3H2O受热完全分解,只得到气体产物和固体产物。 经分析,气体产物只有甲、乙和水蒸气。已知甲、乙均由A、B两元素组成,且摩尔质量:M(甲)>M(乙)。A元素的最外层电子数是次外层电子数的2倍,B元素的主族序数是其所在周期数的3倍。 经分析,固体产物只有Fe、FeO和K2AB3。某同学再进行以下定量分析。

(1)甲的化学式:____________________
(2)溶液②与KMnO4发生氧化还原反应的离子方程式:_______________________
(3)由以上实验数据的分析可知n(Fe):n(FeO):n(K2AB3)= : :
(4)某同学认为:溶液②由紫红色变为无色,振荡试样半分钟内不变色,即可证明溶液②与KMnO4溶液反应达滴定终点。判断该同学设想的合理性并说明理由
湿法炼锌的冶炼过程可用如图简略表示:

请回答下列问题:
(1)NH3的空间构型是 .氨气易液化,液氨常做制冷剂,氨气易液化的原因是_____________________.
(2)已知ZnO属于两性氧化物,写出ZnO与NaOH溶液反应的化学方程式: .
(3)上述电解过程中析出锌的电极反应式为 .
(4)产生的SO2可用Ba(NO3)2溶液吸收,部分产物可作为工业原料,其反应的离子方程式为
(5)氨是最重要的化工产品之一。合成氨用的氢气可以甲烷为原料制得:
CH4(g)+H2O(g) CO(g)+3H2(g)。有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为_______________________.
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为_______________________.



(14分)尿素可作为H2O2的稳定载体,生产一种固态、耐储存、易运输的新型氧化剂和消毒剂—过氧化尿素[CO(NH2)2·H2O2],其合成工艺流程如下:
请回答下列问题:
(1)操作I、II的名称分别是________、_________。CO(NH2)2·H2O2分子中尿素和过氧化氢之间以________结合,其结合力较弱,具有尿素和过氧化氢双重性质。

(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3kJ/mol、285.8kJ/mol
②H2O(l)=H2O(g) H =+44.0kJ/mol
写出CH4与水蒸气作用生产CO2和H2的热化学方程式: 。
(3)为测定产品中H2O2的含量,称取干燥样品12.0g配成250mL溶液,取25.00mL
于锥形瓶中,加入适量硫酸酸化,用0.20mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL.(KMnO4溶液与尿素不反应).
①完成并配平方程式:

②计算出产品中H2O2的质量分数为_____________。
(4)电解含尿素的废水既可以处理废水,又可制得纯氢,电解原理如图所示。电解池中隔膜仅阻止气体通过,A、B两极均为惰性电极。请写出阳极的电极反应方程为_____________。
