CMA(醋酸钙、醋酸镁固体的混合物)是高速公路的绿色融雪剂。以生物质废液——木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)及白云石(主要成分MgCO3·CaCO3,含SiO2等杂质)等为原料生产CMA的实验流程如下:

(1)步骤①发生的反应离子方程式为 。
(2)步骤②所得滤渣1的主要成分为 (写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是 。
(3)已知CMA中钙、镁的物质的量之比与出水率(与融雪效果成正比)关系如右图所示,步骤④的目的除调节n(Ca)∶n(Mg)约为 (选填: 1∶2;3∶7;2∶3)外,另一目的是 。

(4)步骤⑥包含的操作有 、过滤、洗涤及干燥。
(14分)如下图中A~J分别代表有关反应中的一种中学化学常见单质或化合物,其中B、C、D、I均为无色气体,G为白色沉淀。(部分产物和反应条件已略去)
(1)若A加热后得到等物质的量的B和C,则A的化学式为 。
(2)实验室检验B的方法是 。
(3)写出上述由I生成J的化学方程式: 。
(4)写出C和少量Na[Al(OH)4]溶液反应的离子方程式: 。
(5)若实验室要制备纯净的物质C(可含水蒸气)所需试剂最好选择 (填代号)。
A.石灰石
B.稀硝酸
C.稀硫酸
D.稀盐酸
E.纯碱
所需气体发生装置是 (填代号);所选装置中涉及的玻璃仪器的名称为________________________。
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的固体产物具有两性。
(1)若稀硝酸腐蚀锌板产生的气体N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式 。
(2)在操作①中保持pH=8的目的是 。
(3)沉淀I的主要成分是 。
(4)操作③中加热、煮沸的目的是 ;
此步骤操作的理论依据是 。
(5)操作④保持pH=2的目的是 ;
此步骤操作中所用的仪器有带铁圈铁架台、酒精灯、 、 。
下图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置。
试回答:
(1)C、D、G三个装置所盛放的试剂分别是:
C_____________________________________________________
D___________
G
(2)F中的现象为___________________________,生成物是________。
(3)写出在A、E、G中发生反应的化学方程式为:
A: ;
E: ;
G:
明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
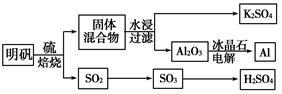
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S 2K2SO4+2Al2O3+9SO2↑+48H2O
2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是 。
(2)从水浸后的滤液中得到K2SO4晶体的方法是 。
(3)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
(共13分)从固体混合物A出发可以发生如下框图所示的一系列变化:

(1)在实验室中常用反应①制取气体C。若要收集气体C,可选择下图装置中的 (填字母)
(2)操作②的名称是 ,在操作②中所使用的玻璃仪器的名称是 。
(3)写出下列反应的方程式:反应①的化学方程式
反应③的化学方程式
(4)在实验室中,要获得干燥纯净的黄绿色气体F,可以将它通过下图中的装置,
其中瓶I中盛放的是 ,瓶II中盛放的是 。
(5)实验中必须吸收多余的气体,以免污染空气。下图是实验室NaOH溶液吸收气体F的装置,为防止发生倒吸现象,合理的装置是 (填选项字母)
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:

根据题意回答下列问题:
(1)实验中需用1 mol·L-1的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有 。
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式: 。
(3)在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为: 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法 。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明主要操作步骤 、 。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为 。
某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| pH |
5.2 |
3.2 |
9.7 |
9.2 |
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、蒸发皿外还需要的主要仪器为 。
(2)“碱浸”过程中发生的离子方程式是 。
(3)“酸浸”时所加入的酸是 (填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是 。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是: 。
(5)“调pH为2~3”的目的是 。
(6)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是 __。
湿法炼锌的冶炼过程可用如图简略表示:

请回答下列问题:
(1)NH3的空间构型是 .氨气易液化,液氨常做制冷剂,氨气易液化的原因是_____________________.
(2)已知ZnO属于两性氧化物,写出ZnO与NaOH溶液反应的化学方程式: .
(3)上述电解过程中析出锌的电极反应式为 .
(4)产生的SO2可用Ba(NO3)2溶液吸收,部分产物可作为工业原料,其反应的离子方程式为
(5)氨是最重要的化工产品之一。合成氨用的氢气可以甲烷为原料制得:
CH4(g)+H2O(g) CO(g)+3H2(g)。有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为_______________________.
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为_______________________.



镁橄榄石主要成分是Mg2SiO4,电解法促进镁橄榄石固定CO2的工艺流程如下图所示:
已知:Mg2SiO4(s)+4HCl(aq) 2MgCl2(aq)+SiO2(s)+2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq)+SiO2(s)+2H2O(l) △H =-49.04 kJ·mol-1
固碳时主要反应的方程式为NaOH(aq)+CO2(g)=NaHCO3(aq)。
(1)上图方框里的操作名称是 ,横线上的物质有(填化学式) 。
(2)下列物质中也可用作“固碳”的是(填字母序号) 。
| A.CaCl2 | B.NH3·H2O |
| C.Na2CO3 | D.H2O |
(3)由下图可知,90 ℃后曲线A溶解效率下降,分析其原因 。
(4)经分析,所得碱式碳酸镁沉淀中含有少量NaCl。为提纯,可采取的方法是 。本流程中可循环利用的物质是(填化学式) 。
(5)另一种橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为 。
利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:
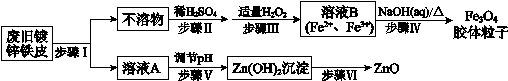
已知:Zn及其化合物的性质与Al及其化合物的性质相似。
回答下列问题:
(1)步骤I中所用的试剂是___________。
(2)步骤III中反应的离子方程式是__________________________________。
(3)步骤V可选用的试剂是_________(填序号)。
a.NaOH溶液 b.氨水 c.盐酸
(4)步骤VI的实验操作是_____________。
已知孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeO、SiO2。现以孔雀石为原料制备CuSO4·5H2O。
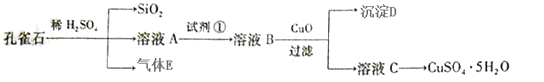
(1)实验步骤中试剂①最佳选择 (填代号);
a.H2O2 b.Cl2 c.KMnO4 d.HNO3
请写出其对应的离子方程式 。
(2)溶液B中加入CuO作用是 。
(3)由溶液C获得CuSO4·5H2O晶体,需要经___________、____________和过滤。
(4)25 ℃,Fe(OH)3的Ksp=1×10-38,若要将溶液中的Fe3+沉淀完全,必需调节溶液pH> 。
(5)实验室用惰性电极电解500ml的CuSO4溶液一段时间后,撤去电源,若加入0.2mol Cu(OH)2恰好使电解液恢复到原来状态,则电解过程中转移电子的物质的量为__________mol,原CuSO4溶液的物质的量浓度为________mol·L-1。
铁及其化合物有重要用途,如聚合硫酸铁[]是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品: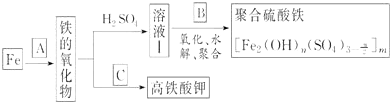
请回答下列问题:
(1)若A为H2O(g),写出反应方程式___________________________;
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-)_________________;
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸钾(K2FeO4)的化学方程式,并配平:
□Fe2O3+□KNO3+□KOH→□ ________ +□KNO2+□ ______
(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol・L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2; I2+2S2O32-═2I-+S4O42-
①滴定选用的指示剂及滴定终点观察到的现象__________________________;
②溶液Ⅰ中铁元素的总含量为__________ g・L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会________(填“偏高”“偏低”或“不变”)。
(14分)尿素可作为H2O2的稳定载体,生产一种固态、耐储存、易运输的新型氧化剂和消毒剂—过氧化尿素[CO(NH2)2·H2O2],其合成工艺流程如下:
请回答下列问题:
(1)操作I、II的名称分别是________、_________。CO(NH2)2·H2O2分子中尿素和过氧化氢之间以________结合,其结合力较弱,具有尿素和过氧化氢双重性质。

(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3kJ/mol、285.8kJ/mol
②H2O(l)=H2O(g) H =+44.0kJ/mol
写出CH4与水蒸气作用生产CO2和H2的热化学方程式: 。
(3)为测定产品中H2O2的含量,称取干燥样品12.0g配成250mL溶液,取25.00mL
于锥形瓶中,加入适量硫酸酸化,用0.20mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL.(KMnO4溶液与尿素不反应).
①完成并配平方程式:

②计算出产品中H2O2的质量分数为_____________。
(4)电解含尿素的废水既可以处理废水,又可制得纯氢,电解原理如图所示。电解池中隔膜仅阻止气体通过,A、B两极均为惰性电极。请写出阳极的电极反应方程为_____________。

(15分)电子垃圾含70%Cu、25%Al、4%Fe以及少量Pt、Au)实验室现欲回收处理制备硫酸铜和硫酸铝晶体,合成路线如下
查阅资料获取下列信息Cu可与H2SO4、H2O2反应生成CuSO4;铁铝铜等离子沉淀为氢氧化物的PH值如表所示
请回答下列问题
(1)写出Cu与稀H2SO4、H2O2反应的离子方程式 ;
(2)操作Ⅱ中X的取值范围 ;
(3)操作Ⅲ中蒸发浓缩所需的玻璃仪器 ;
(4)操作中的滤渣生成Al2(SO4)3·18H2O的化学方程式 ;
(5)为测定CuSO4 ·5H2O晶体的纯度,取ag试样配成100ml溶液,取25.00ml,消除干扰离子后,用 b mol.L-1EDTA(Na2H2Y)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+)滴定至终点平均消耗EDTA12.00ml,则CuSO4·5H2O的纯度为 。