下列气体不能用排空气法收集的是
| A.NO | B.NO2 | C.SO2 | D.NH3 |
实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
试回答下列问题:
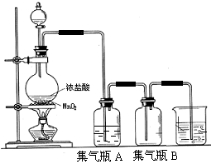
(1)实验室中可采用 溶液来吸收有毒的氯气,写出该反应的离子方程式 。
(2)实验取质量分数为36.5%,密度为1.19g·cm-3,浓盐酸100mL,反应结束后测得盐酸的浓度变为1.9mol/L,(忽略体积的变化)请你计算出实验过程生成标况下的Cl2多少L(写出计算过程)
Ⅰ.某课外活动小组为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。
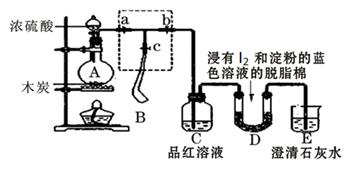
请回答下列问题
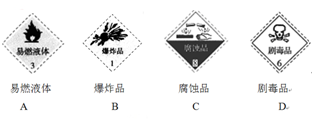
(1)对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签。浓硫酸的危险警告标签是 。
(2)装置A中发生反应的化学方程式为_______________________。
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是_________________(用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为______________________________;
(5)当D中产生____________现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;写出D中发生反应的化学方程式,并标出电子转移方向和数目______________。
Ⅱ. Cu与浓硫酸反应可得硫酸铜溶液。某学习小组将铜屑放入一定浓度的硫酸中,加热并不断鼓入空气也可得硫酸铜溶液,其反应原理为2Cu+O2+2H2SO4="=" 2CuSO4+2H2O。现欲将12.8g铜完全溶解,加蒸馏水后得200 mL溶液。计算:
(6)参加反应的氧气在标准状况下的体积是___________ L。(不必写计算过程)
(7)所得硫酸铜溶液的物质的量浓度是___________ mol/L(不必写计算过程)
下列制备和收集气体的实验装置合理的是
A. 用锌粒和稀硫酸制H2 用锌粒和稀硫酸制H2 |
B. 用H2O2和MnO2制O2 用H2O2和MnO2制O2 |
C. 用氯化铵和氢氧化钙固体制NH3 用氯化铵和氢氧化钙固体制NH3 |
D. 用铜片和稀硝酸制NO 用铜片和稀硝酸制NO |
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的是( )

| A.用装置甲制取氯气 |
| B.用装置乙除去氯气中混有的少量氯化氢 |
| C.用装置丙分离二氧化锰和氯化锰溶液 |
| D.用装置丁蒸干氯化锰溶液制MnCl2•4H2O |
(1)某课外小组设计的实验室制取乙酸乙酯的装置如下图所示,A中盛有浓硫酸,B中盛有乙醇、乙酸,D中盛有饱和碳酸钠溶液。

请回答:
① 乙醇与乙酸制取乙酸乙酯的反应类型是 。
② 若用18O标记乙醇中的氧原子,则CH3CH218OH与乙酸反应的化学方程式是 。
③ 球形干燥管C的作用是 。
④ D中选用饱和碳酸钠溶液的原因是 。
⑤ 反应结束后D中的现象是 。
(2)下列叙述正确的是 (填字母)。
| A.向碘水中加入酒精,萃取碘水中的碘 |
| B.液化石油气、汽油和石蜡的主要成分都是碳氢化合物 |
| C.用淀粉水解液做银镜反应,若有银镜产生,则证明淀粉部分水解 |
| D.将无水乙醇和浓硫酸按体积比1∶3混合,加热至140℃制取乙烯 |
E.为证明溴乙烷中溴元素的存在,可向溴乙烷中加入NaOH溶液,加热;冷却后,加入稀硝酸至溶液呈酸性,滴入AgNO3溶液观察是否有淡黄色沉淀生成
氮及其化合物在生产、生活中有着非常重要的作用。题中相关的实验装置如下:
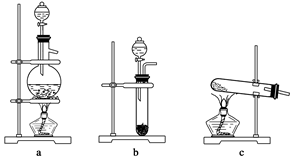

(1)实验室制取较为干燥的氨气的反应方程式为 ;可选择上图中的装置a、b、c中的 (填代号)来制取。
(2)实验室通过使用氮气和氢气模拟工业合成氨和氨催化氧化的流程如下:
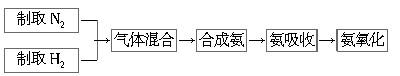
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热反应制取氮气。
①写出上述制取氮气的反应的化学方程式: ;
②从上图a、b、c中选择制取气体的合适装置(填代号):N2_______、H2________。
③氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,___________(“会”或“不会”)发生倒吸。
④用乙装置吸收一段时间氨后,再通入空气,同时将热的铂丝插入乙装置的锥形瓶内,写出装置中氨的催化氧化的化学方程式:_____________。
⑤乙装置的锥形瓶内铂丝保持红热的原因是________________。
⑥反应结束后锥形瓶内溶液中的含氮离子有_____________(填离子符号) 。
(3)农村有句谚语——雷雨肥庄稼,即雷雨时自然界发生了一系列的反应,合成了植物生长需要的氮肥,有利于植物生长。这其中使游离态的氮直接转化为化合态的氮的化学反应方程式为 。
(4)目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,该化学反应方程式为 。
(5)一定条件下, N2O和CO的混合气体在点燃条件下恰好完全反应,生成的三种产物均为大气组成气体,并测得反应后气体的密度为反应前气体密度的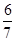 倍。请写出该反应的化学方程式 。
倍。请写出该反应的化学方程式 。
实验室制备下列气体的方法可行的是( )
| |
气体 |
方法 |
| A |
氨气 |
加热氯化铵固体 |
| B |
二氧化氮 |
将铝片加到冷浓硝酸中 |
| C |
硫化氢 |
向硫化钠固体滴加浓硫酸 |
| D |
氧气 |
加热氯酸钾和二氧化锰的混合物 |
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
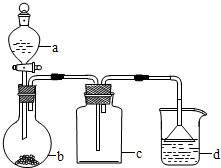
| 选项 |
a中的物质 |
b中的物质 |
c中收集的气体 |
d中的物质 |
| A |
浓氨水 |
CaO |
NH3 |
H2O |
| B |
浓硫酸 |
Na2SO3 |
SO2 |
NaOH溶液 |
| C |
稀硝酸 |
Cu |
NO2 |
H2O |
| D |
饱和食盐水 |
MnO2 |
Cl2 |
NaOH溶液 |
某学生在如下图所示装置中用苯和液溴制取溴苯,请根据下列实验步骤完成有关问题:
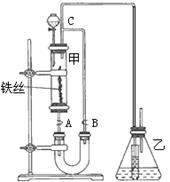
(1)第一步,在分液漏斗中依次加入10 mL苯和5 mL液溴,使之混合均匀,此时观察到溴溶于苯,不反应,溶液呈深棕红色。
第二步,打开分液漏斗活塞,将苯、溴混合液按一定速率逐滴加入玻璃管甲中的铁丝上,观察到的现象是剧烈反应,玻璃管甲和导管C中有橙红色蒸气。从上述两步观察到的现象差异,可得出的结论是______________________。
(2)第三步,几分钟后,打开胶皮管夹A和B,使反应混合液流入U形管中,打开管夹B的原因是______________________;然后通过分液漏斗向U形管中加入适量的NaOH溶液,目的是(用化学方程式表示)_ 。
(3)第四步,关闭胶皮管A和B,连同A和B一起取下U形管,用力振荡并静置后,观察到无色的溴苯,它在U形管中液体的_ (填“上”或“下”)层。
(4)要证明上述溴跟苯的反应是取代而不是加成反应,请根据装置乙的作用完成下列各题:
小试管内的液体是__________(填名称)。
锥形瓶内的液体是__________(填名称)。
反应后,向锥形瓶内滴加试剂__________(填名称)溶液,作用是 。
(5)写出上述苯跟溴反应的化学方程式__________________________。
菠菜是一种富含草酸(乙二酸)的绿色蔬菜,但食用时要避免和豆腐同时食用,因为二者容易产生难溶于水的物质而在体内生成结石。草酸也是有机化工中的重要原料,广泛应用于化工生产中。为探究草酸的某些性质,某中学化学兴趣小组查阅了一些资料如下:
| 物质 |
结构 |
某些性质 |
| 草酸 |
分子式:H2C2O4·2H2O |
无色,易溶于水;其钠盐和钾盐易溶于水,钙盐难溶于水 |
| 结构简式:HOOC-COOH |
熔点:101℃;升华温度:125℃;170℃以上分解 |
回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。
装置C中可观察到的现象是①导管口有气泡出现 ②石灰水变浑浊,由此可知草酸晶体分解的产物有__________。装置B的主要作用是_______________。若无此装置C中可能发生的反应的化学方程式为___________________。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为了进行验证,选用甲组实验中的装置A、B和下图所示的部分装置进行实验。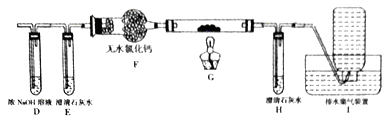
①乙组的实验装置中,装置E和H中的澄清石灰水的作用分别是_________和__________;装置G反应管中盛有的固体物质是___________;I中集气瓶收集到的气体主要是_______________。
②能证明草酸晶体分解产物中有CO的现象是____________________________。
某化学小组用如图所示装置制取氯气。下列说法正确的是
| A.该装置图中至少存在三处明显错误 |
| B.该实验中收集氯气的方法不正确 |
| C.如果需要得到干燥纯净的,只需在气体发生装置和收集装置之间连接一个装有浓硫酸的洗气瓶即可 |
| D.含有2 mol HCl的某浓盐酸与足量MnO2混合,在一定条件下反应,转移1 mol电子 |