向50 mL 1 mol/L AlCl3溶液中加入1 mol/L NaOH溶液a mL,充分反应后,生成的沉淀为0.02 mol,a有两个可能的数值,其中一个是180,另一个数值是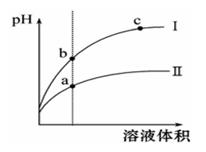
| A.40 | B.60 | C.80 | D.90 |
下列有关溶液pH的说法正确的是
| A.将pH=11的氢氧化钠溶液加水稀释100倍,溶液中c(H+)=10-13mol/L |
| B.将pH=9的氢氧化钠溶液和pH=13的氢氧化钡溶液等体积混合,所得混合溶液的pH=11 |
| C.将pH=1的硫酸溶液和pH=5的盐酸等体积混合,所得混合溶液的pH=1.3 |
| D.pH=13的氢氧化钡溶液和pH=1的盐酸等体积混合,由于氢氧化钡过量,所得溶液的pH>7 |
常温下,0.1 mol/L某一元酸(HA)溶液中 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol/L
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D.与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为
c(A-)>c(Na+)>c(OH-)>c(H+)
常温下有一PH为12的NaOH溶液100mL,如果将其PH将为11,那么
(1)若用蒸馏水应加入 mL (2)若用PH=10的NaOH溶液应加入 mL
(3)若用PH=2的盐酸应加入 mL (4)若用0.01mol/L的硫酸溶液应加入 mL
分别取pH=2的两种一元酸HX和HY的溶液各50 mL,加入过量的镁粉,充分反应后,收集H2的体积在相同状况下分别为V1和V2,若V1>V2,下列说法正确的是( )
| A.HX一定是弱酸 | B.NaX水溶液的碱性弱于NaY水溶液的碱性 |
| C.HX一定是强酸 | D.反应过程中二者生成H2的速率相同 |
室温下,酸和碱的溶液等体积混合后,pH一定大于7的是( )
| A.pH=3的盐酸与 pH=11的氢氧化钡溶液 | B.pH=2的醋酸和pH=12的氢氧化钠溶液 |
| C.pH=3的硝酸与pH=11的氨水 | D.pH=2的硫酸与pH=12的氢氧化钾溶液 |
关于氯化铁水解的说法错误的是 ( )
| A.水解达到平衡(不饱和)时,无论加氯化铁饱和溶液还是加水稀释,平衡均向正方向移动 |
| B.浓度为5 mol/L和0.5 mol/L的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小 |
| C.有50℃和20℃的同浓度的FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小 |
| D.为抑制Fe3+水解,较好地保存FeCl3溶液,应加少量盐酸 |
现有常温时pH=1的某强酸溶液10 mL,下列操作能使溶液的pH变成2的是 ( )
| A.加水稀释成100 mL |
| B.加入10 mL的水进行稀释 |
| C.加入10 mL 0.01 mol·L-1的NaOH溶液 |
| D.加入10 mL 0.01 mol·L-1的HCl溶液 |
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为__ (填序号)。
| A.9 | B.13 | C.11~13之间 | D.9~11之间 |
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中
c(Na+)_______c(CH3COO-) ( “>”、“=”或“<”)。
(3)常温下,0.10mol/LNH4Cl溶液中各离子浓度由大到小的顺序是_____________ _。
(4)将NaHCO3溶液跟Al2(SO4)3溶液混合,现象是 ,相关反应的离子方程式是 。
表示0.1mol·L-1 NaHCO3溶液中有关微粒浓度的关系式中正确的
| A.C(Na+)>C(HCO3-)>C(CO32-)>C(H+)>C(OH-) |
| B.C(Na+) = C(HCO3-) |
| C.C(Na+)+C(H+) = C(HCO3-)+2C(CO32-)+C(OH-) |
| D.C(Na+) = C(HCO3-)+C(CO32-)+C(H2CO3) |
在a LAl2(SO4)3和(NH4)2SO4的混合溶液中加入 ,恰好使溶液中的SO42—离子完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol/L)为( )
,恰好使溶液中的SO42—离子完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol/L)为( )
A. |
B. |
C. |
D. |
已知复分解反应:2 CH3COOH+Na2CO3==2CH3COONa+ H2O+CO2↑可自发进行。在常温下,测得浓度均为0.1mol/L的下列六种溶液的PH:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| PH值 |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
表中数据提示出复分解反应的一条规律,即碱性较强的物质发生类似反应可生成碱性较弱的物质。依据该规律,请你判断下列反应不能成立的是:
| A.CO2 +H2O+ NaClO="=" NaHCO3+HClO | B.CO2 +H2O+ 2NaClO="=" Na2CO3+2HClO |
| C.CH3COOH+ NaCN="=" CH3COONa+HCN | D.CH3COOH+ NaClO="=" CH3COONa+ HClO |
已知在一密闭绝热容器中,饱和石灰水中存在平衡:Ca(OH)2(s)  Ca2+(aq)+2OH-(aq),现向其中加入少量CaO粉末,则下列说法错误的是:
Ca2+(aq)+2OH-(aq),现向其中加入少量CaO粉末,则下列说法错误的是:
| A.析出固体的质量增加 | B.溶液的pH值不变 |
| C.溶液中的OH-数目减少 | D.溶液中的Ca2+浓度减小 |
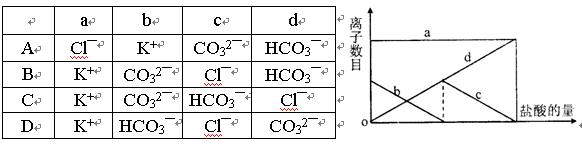
向一定量的K2CO3溶液中缓慢滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是 ( )