高锰酸钾(KMnO4)是一种常用的氧化剂。
(1)有下列变化:CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,找出其中一个变化与“MnO4-→Mn2+”组成一个反应,写出该反应的离子方程式: 。
(2)高锰酸钾可代替二氧化锰用来制取Cl2,则反应中氧化剂和还原剂的物质的量之比为 。
(3)高锰酸钾与硫化亚铁有如下反应:10FeS+6KMnO4+24H2SO4=3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O。若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生转移的电子数目为 。
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式 。
(2)整个过程中的还原剂是 。
(3)把KI换成KBr,则CCl4层变为 色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为20~50 mg·kg-1。制取加碘盐(含KIO3的食盐)1 000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。
近年来地质、环境灾难频频发生,为防止在大灾之后疫病流行,灾区需要大量的各种消毒剂、漂白剂等。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3与SO2在H2SO4作用下反应制得。请写出反应的离子方程式: 。
(2)过碳酸钠是一种新型固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是 。
| A.MnO2 | B.KMnO4溶液 | C.稀盐酸 | D.Na2SO3溶液 |
(3)漂白剂亚氯酸钠(NaClO2)在常温下黑暗处可保存一年,HClO2不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2分解时,转移的电子数是 。
已知33As、35Br位于同一周期。某反应中反应物与生成物有以下几种:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式是 。
(3)在该反应条件下可推知 (填序号)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将该反应方程式配平后,氧化剂和还原剂的物质的量之比为 ,其中1 mol KBrO3得到电子的物质的量为 mol。
利用I2O5可消除CO污染或定量测定CO,反应为:5CO(g)+I2O5(s) 5CO2(g)+I2(s);ΔH 1
5CO2(g)+I2(s);ΔH 1
(1)已知:2CO(g)+O2(g) 2CO2(g);ΔH 2
2CO2(g);ΔH 2
2I2(s)+5O2(g) 2I2O5(s);ΔH 3
2I2O5(s);ΔH 3
则ΔH 1= (用含ΔH 2和ΔH 3的代数式表示)。
(2)不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2molCO,测得CO2的体积分数φ(CO2)随时间t变化曲线如图。请回答: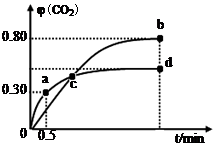
①从反应开始至a点时的反应速率为v(CO)= ,b点时化学平衡常数Kb= 。
②d点时,温度不变,若将容器体积压缩至原来的一半,请在图中补充画出CO2体积分数的变化曲线。
③下列说法正确的是 。(填字母序号)
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的平均相对分子质量相等 |
| C.增加I2O5的投料量有利于提高CO的转化率 |
| D.b点和d点的化学平衡常数:Kb<Kd |
(3)将500mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管,170℃下充分反应,用水—乙醇液充分溶解产物I2,定容到100mL。取25.00mL,用0.0100mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00mL,则样品气中CO的体积分数为 。(已知:气体样品中其他成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)
现有下列十种物质:
①H2;②铝;③CaO;④CO2;⑤H2SO4;⑥Ba(OH)2;⑦红褐色的氢氧化铁液体;⑧氨水;⑨稀硝酸;⑩Al2(SO4)3
上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 |
金属单质 |
氧化物 |
溶液 |
胶体 |
电解质 |
| 属于该类的物质 |
|
|
|
|
|
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-= H2O,该离子反应对应的化学方程式为 。
(3)⑩在水中的电离方程式为 ,
(4)少量的④通入⑥的溶液中反应的离子方程式为 。
(5)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,该反应的氧化剂是 (填化学式),氧化剂与还原剂的物质的量之比是 ,当有5.4g Al发生反应时,转移电子的物质的量为 。该反应的离子方程式为 。
目前雾霾现象较严重,某些燃料的过度使用是原因之一,有人提出二甲醚是一种重要的清洁燃料。工业上可利用煤的气化产物合成二甲醚。请回答下列问题:
(1) 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)+CO(g) CH3OH(g); ΔH=-90.8kJ·mol-1
CH3OH(g); ΔH=-90.8kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+H2O(g); ΔH=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g); ΔH=-23.5kJ·mol-1
③ CO(g)+H2O(g) CO2(g)+H2(g); ΔH=-41.3kJ·mol-1
CO2(g)+H2(g); ΔH=-41.3kJ·mol-1
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH= ;
CH3OCH3(g)+CO2(g)的ΔH= ;
(2)工业上还可利用上述反应中的CO2和H2合成二甲醚反应如下:
6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知该反应平衡常数(K)与温度(T)的关系如图所示:

①该反应的平衡常数表达式为 。
②若升高温度,则平衡向 反应方向移动(填“正”或“逆”)
③一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应
达到化学平衡状态的是 (选填编号)。
a.c(H2)与c(H2O)的比值保持不变 b.单位时间内有2mol H2消耗时有t mol H2O生成
c.容器中气体密度不再改变 d.容器中气体压强不再改变
(3) 氢能源是理想的能源,是治理雾霾现象的途径之一。
①用丙烷和水为原料在电催化下制氢气,同时得到一种含有单三元环的环氧化合物A,该反应的化学方程式为 ; 该反应也可生成A的同分异构体——另一种环氧化合物B,B的核磁共振氢谱为下图中的 (填“a”或“b”)。

②已知叠氮酸(HN3)不稳定,同时也能与活泼金属反应,反应方程式为:
2HN3=3N2↑+H2↑
2HN3+Zn=Zn(N3)2+H2↑
0.2mol HN3与一定量Zn完全反应,在标准状况下生成6.72L气体,其中被金属锌还原HN3物质的
量为 。
过碳酸钠(xNa2CO3·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取2.3840g样品,配制成100ml溶液A 。②准确量取25.00 ml溶液A,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.788g。③准确量取25.00 ml溶液A,加入适量稀硫酸酸化后,用0.06400mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 ml。H2O2与KMnO4反应的离子方程式如下:
2MnO4-+5H2O2+6H+=4Mn2++8H2O+5O2↑
(1)滴定操作时高锰酸钾溶液应装在 (酸式或碱式)滴定管;滴定终点的现象是
(2)向上述滴定后的溶液中,加入氢氧化钠溶液可得白色沉淀,后立即被空气中的氧气氧化成棕色的 MnO(OH)2,其总反应的离子方程式为: 。
(3)通过计算确定过碳酸钠的组成(写出计算过程)。
催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
⑴人们常用催化剂来选择反应进行的方向。如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。
①在有催化剂作用下,CH3OH与O2反应主要生成 (填“CO、CO2或HCHO”)。
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H= 。
③在稀硫酸催化下,HCHO可以通过反应生成分子式为C3H6O3的环状三聚甲醛分子,其分子中同种原子的化学环境均相同。写出三聚甲醛的结构简式: 。
④甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性,用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: 。
⑵一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O="2n" CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 ;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为 g。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
⑴工业上处理酸性含Cr2O72-废水的方法如下:
①向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式: 。
②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为 ;25℃,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为 mol/L。(已知25℃时,Ksp[Cr(OH)3]=6.3×10-31)
⑵铬元素总浓度的测定:准确移取25.00mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015mol/L的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mL。
计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。
已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O =Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O
③I2+2S2O32-=2I-+S4O62-
A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据下图转化关系(反应条件及部分产物已略去),回答下列问题: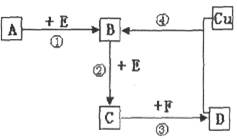
(1)若A、B、C、D均为含硫元素的化合物,A是一种常见的矿石的主要成分,且A的摩尔质量为120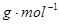 。 反应①的化学方程式为 ;
。 反应①的化学方程式为 ;
(2)若A、B、C、D均为含氮元素的化合物,且A的一个分子中只含有10个电子,则:
①A分子式为__________;
②反应④的离子方程式为________________________________________________
③取Cu和Cu2O的混合物样品12.0g,加入到足量的D的稀溶液中,用排水法收集产生的气体,标准状况下其体积为2.24L,则样品中Cu2O的质量为__________g。
在常见的非金属及其化合物中:
(1)晶体硅的导电性介于导体和绝缘体之间,是良好的 材料;硅酸钠水溶液俗称为 ,是制备硅胶和木材防火剂的原料;陶瓷、 、水泥等硅酸盐产品是使用量最大的无机非金属材料。
(2)氯元素是重要的“成盐元素”,将氯气通入NaOH溶液中可以得到漂白液,反应的离子方程式是 ;漂白液有效成分的化学式为 。
(3)水是常见的非金属元素化合物,请按要求写出下列水参加的反应的化学方程式。
①水只作氧化剂:
②NO2气体通入水中:
③水既作氧化剂又作还原剂:
将5.5 g铁铝混合物粉末加入900mL 1.00 mol/L HNO3溶液中,充分反应后,得a L(标准状况)NO气体。
(1)HNO3是否过量___________。
(2)若a=3.36L(标准状况),则混合物中铝的质量分数为_________%。
(3)若a=3.36L(标准状况),往反应后的溶液中加入___________ mL 1.000 mol/L NaOH溶液时生成的沉淀量最大,还要加________ mL 1.000 mol/L NaOH溶液才能使沉淀的量保持不变。
Ⅰ.高铁酸钾(K2FeO4)是极好的氧化剂,具有高效的消毒作用,为一种新型非氯高效消毒剂。其生产工艺流程如下: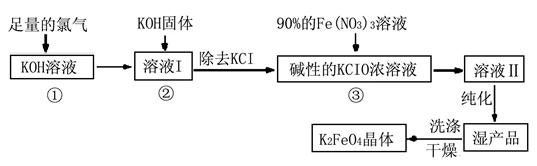
请同答下列问题。
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式 。
(2)在溶液I中加入KOH固体的目的是 (选填序号)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解会放出较多的热量,有利于提高反应速率和KClO的纯度 |
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。要制得69.3克K2FeO4,理论上消耗氧化剂的物质的量为 mol。
(4)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,
3Zn+2K2FeO4+8H2O,
放电时电池的负极反应式为 。
Ⅱ.肼(N2H4)又称联氨,是一种可燃性的液体,用作火箭燃料。
(5)写出肼分子的电子式 。
(6)肼能与N2O4反应:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7 kJ/mol。
已知:N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ/mol, 写出肼与O2反应生成N2和H2O(g)的热化学方程式 。
已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
(1)用离子方程式解释NaHC2O4溶液显酸性的原因:________________。
(2)常温下,向10mL 0.01mol/L NaHC2O4溶液中滴加10mL 0.01mol/L NaOH溶液时,比较所得溶液中各种离子浓度的大小关系:________________。
(3)配平以下氧化还原反应方程式。

(4)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份该溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入2滴酚酞试液,滴加20 mL 0.25 mol/L NaOH溶液时,溶液由无色变为浅红色。该溶液中被中和的H+的物质的量为________mol。
②第二份溶液中滴加16mL 0.10mol/L酸性KMnO4溶液时反应完全,该溶液中还原剂的物质的量为________mol。
③原试样中H2C2O4·2H2O的物质的量为________mol,KHC2O4的质量分数为________。