铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸的冶炼钢铁的重要原料。高温下可发生反应:其中一个反应为:3FeS2+8O2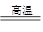 6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
(2)氯化铝溶液显酸性,原因是_________________________(用离子方程式稀释);
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素(CO(NH2)2;它易被氧化),原理如下图所示。
①电源的负极为_________(填“A”或“B”)。
②阳极室中发生的反应依次为_________、_________。
③电解结束后,阴极室溶液的pH与电解前相比将_________;若阴极共收集到气体6.72L(标准状况),则除去的尿素为________ g(忽略气体的溶解)。
(4)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2。已知:2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•moL-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•moL-1
H2O(g)═H2O(l)△H=-44.0kJ•moL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:_________。
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
(1)单质A是一种黄色固体,组成单质A的元素在周期表中的位置是________________。用物理方法洗去试管内壁的A,应选择的试剂是_______________;化学方法洗去试管内壁的A是发生歧化反应生成两种盐,但这两种盐在强酸性条件下不能大量共存,请写出化学方法洗去试管内壁的A时发生的化学反应方程式______________________________。
(2)工业上获得B时常使用电解法,请写出阳极反应的电极反应_________________。
(3)FeCl3溶液中的Fe3+可以催化G与氧气在溶液中的反应,此催化过程分两步进行,请写出Fe3+参与的第一步反应的离子反应方程式_____________________________。
(4)工业上吸收E常用氨水,先生成正盐最终产物为酸式盐。E与该正盐反应的化学方程式___________________________.
(5)将D溶于稀硫酸,向恰好完全反应后所得的溶液中加入过量氢氧化钡溶液,则加入氢氧化钡溶液的过程中的现象是_____________________________。
(6)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为__________,当生成2mol二氧化氯时,转移电子___________mol。
(7)H的溶液与稀硫酸反应的化学方程式______________________________。
(1)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的 I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是用离子方程式解释 .
(3)在100mLFeBr2溶液中通入标况下2.24LCl2, 溶液溶液中有1/4的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
(4)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式____ 。向反应后的溶液中通入过量CO2,反应的离子方程式为 _______________________________。
(5)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式 ,反应中生成0.2mol HNO3,转移的电子数目为 。②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是 。
碘化钾溶液久置于空气中,发生如下反应:
______KI+______O2+______H2O=______I2+______KOH
(1)在______上填上正确的化学计量数并用双线桥法标出电子转移的方向和数目;
(2)在该反应中,还原产物是________(填化学式);
(3)当有0.2mol电子发生转移时,生成I2的质量为________g。
孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2。以孔雀石为原料可制备CuSO4·5H2O步骤如下:

(1)写出孔雀石与稀硫酸反应的化学方程式:___________,
为了提高原料浸出速率,可采取的措施有____________(写出两条)。
(2)溶液A的金属离子有Cu2+、Fe2+。实验步骤中试剂①最佳选 (填代号)。
a.KMnO4 b.Cl2 c.H2O2 d.HNO3
(3)溶液B中加入CuO作用是_________________ ____。
(4)常温下Fe(OH)3的Ksp=1×10-39,若要将溶液中的Fe3+转化为Fe(OH)3沉淀,使溶液中c(Fe3+)降低至1×10—3mol/L,必需将溶液pH调节至 。
(5)由溶液C获得CuSO4·5H2O晶体,需要经____________、___________和过滤。
(6)可用KMnO4标准溶液测定溶液A中Fe2+的浓度,量取A溶液20.00ml,用0.010mol/L酸性KMnO4标准溶液滴定,消耗KMnO4 10.00ml, A溶液中Fe2+的物质的量浓度_________mol/L.
(反应原理:MnO4- + 5Fe2++8H+=Mn2++5Fe3++4H2O)
下图所示为含Cr化合物在一定条件下的转化: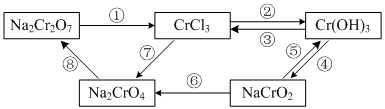
(1)①~⑧所示转化中,需要加入氧化剂才能实现的是_______(填写序号)。
(2)在上述转化中,既能与强酸反应又能与强碱反应的两性物质是______(填化学式)。
(3)转化①可通过下列反应实现:
①完成并配平的化学方程式:
__Na2Cr2O7+__KI+__H2SO4——__Cr2(SO4)3+__Na2SO4+__K2SO4+__I2+__H2O
②用单线桥表示电子转移的方向和数目
③反应中每转移0.4mol电子,生成I2的物质的量为______mol。
A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成。B、C的组成元素相同,且C的摩尔质量比B大80g/mol,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为 。
A、离子键 B、极性共价键 C、非极性共价键 D、氢键
(2)下表为B与F实验的部分内容
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出B与稀H2SO4反应的离子方程式___________,写出②中离子反应方程式__________。
(3)现由6种粒子Mn2+、MnO4-、H+、H2O、X2Y82-(C中含有的阴离子),XY42-完成一个离子方程式,已知Mn2+为还原剂,得到1mol MnO4-需氧化剂的物质的量为 mol。
(4)化合物D和E相互转化D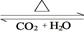 E,若有D和E·
E,若有D和E·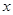 H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E·xH2O的化学式为 。
H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E·xH2O的化学式为 。
测血钙的含量时,可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式 。
(2)判断滴定终点的方法是 。
(3)计算:血液中含钙离子的浓度为 mol/L。
氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答下列问题:
(1)NA表示阿伏加德罗常数的数值。69g NO2和N2O4的混合气体中含有____NA个氧原子;2L 0.6 mol/LFe(NO3)3溶液中含_____NA个NO3-离子。
(2)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,
① 写出该反应的化学方程式 .
若反应中生成0.15 mol HNO3,转移的电子数目为________个.
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F;据题意推测 NF3、F2、NO三种气体中,氧化性由强到弱的顺序为
③NF3是一种无色、无臭的气体,一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有_______________(填化学式).
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关.当n(KOH)="a" mol时,
的值与温度高低有关.当n(KOH)="a" mol时,
(1)标准状况下,参加反应的氯气的体积等于 L
(2)若某温度下,反应后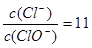 ,则溶液中
,则溶液中 = ,此时反应总离子方程式为 .
= ,此时反应总离子方程式为 .
(3)改变温度,产物中KClO3的最大理论产量为 mol.
氯碱工业生产中用氨气检查氯气管道是否泄漏,氨气遇到氯气会产生白烟,
(1)反应还生成了一种无毒的气态单质,写出反应的化学方程式 ________________________。
(2)在该反应中,氧化剂是____________,还原产物是____________,当有1.7g的氨气参与反应时,转移的电子数目为____________。
(3)列式计算当有112 mL的氯气(已折算到标准状况)参加反应时生成白烟的质量为________ g。
危化仓库中往往存有钠、钾、硫、白磷(P4)、硝酸铵和氰化钠(NaCN)等危险品。请回答下列问题:
(1)NH4NO3为爆炸物,在某温度下按下式进行分解:5NH4NO3 =4N2 ↑+ 2HNO3 + 9H2O
则被氧化和被还原的氮元素质量之比为_____________;
(2)硫酸铜溶液是白磷引起中毒的一种解毒剂:1lP4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为______________mol;
(3)NaCN属于剧毒物质,有一种处理方法其原理为:CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色弱电解质,另一种与H+作用产生能使品红溶液腿色的刺激性气体,写出离子反应方程式:_________________________________。
氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答下列问题:
(1) 表示阿伏加德罗常数的数值,69g
表示阿伏加德罗常数的数值,69g 和
和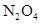 的混合气体中含有__________个氧原子;2L 0.6 mol/L
的混合气体中含有__________个氧原子;2L 0.6 mol/L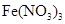 溶液中含_________个
溶液中含_________个 离子。
离子。
(2)三氟化氮( )是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:
)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: 、
、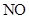 和
和 ,
,
① 写出该反应的化学方程式 .
若反应中生成0.15 mol  ,转移的电子数目为________个.
,转移的电子数目为________个.
②三氟化氮可由氨气和氟气反应得到: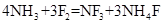 ;据题意推测
;据题意推测 ,
, ,
,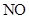 三种气体中,氧化性由强到弱的顺序为____________________
三种气体中,氧化性由强到弱的顺序为____________________
③ 是一种无色、无臭的气体,一旦
是一种无色、无臭的气体,一旦 泄漏,可以用
泄漏,可以用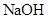 溶液喷淋的方法减少污染,其产物除
溶液喷淋的方法减少污染,其产物除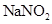 、
、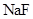 、
、 外,还肯定有_____________(填化学式).
外,还肯定有_____________(填化学式).
(3)氨和联氨(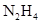 )是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
(每空2分,共6分)储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为: C+
C+ K2Cr2O7+
K2Cr2O7+ H2SO4→
H2SO4→ CO2↑+
CO2↑+ K2SO4+
K2SO4+ Cr2(SO4)3+
Cr2(SO4)3+ H2O
H2O
(1)完成并配平上述反应的化学方程式并标出电子转移方向与数目(单线桥法);
___
(2)此反应的氧化产物是__ __;
(3)上述反应中若产生0.1 mol CO2气体,则转移电子的物质的量是__0.4__ mol。