NA2Sx在碱性溶液中可被NAClO氧化为NA2SO4,而NAClO被还原为NACl,若反应中NA2Sx与NAClO的物质的量之比为1∶16,则x的值为
| A.2 | B.3 | C.4 | D.5 |
在FeCl3和CuCl2的混合溶液中加入过量铁粉,反应完全后剩余固体的质量大于加入的铁粉质量。已知原混合溶液中FeCl3为0.4 mol,则CuCl2的物质的量可能是
| A.0.2 mol | B.0.6 mol | C.1.2 mol | D.2 mol |
向含a mol H2SO4的质量分数为98%的浓硫酸中加入足量的铜片并加热,充分反应后有b mol H2SO4被还原,则a和b的关系是
| A.a=b | B.a=2b | C.a / 2 < b < a | D.a >2b |
32g铜与150mL一定浓度的硝酸恰好完全反应,产生的NO2和NO混合气体在标准状况下的体积为11.2L。则该硝酸的物质的量浓度为
| A.5mol/L | B.15mol/L | C.10mol/L | D.8mol/L |
取铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生0.896L NO2气体和0.672 L N2O4的气体(气体体积都已折算到标准状况),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为3.7g。则合金中铜与镁的物质的量之比等于
| A.1 :1 | B.2 :1 | C.3 :2 | D.2 :3 |
将和
的混合气体448
通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8
气体。原混合气体中
的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)
| A. |
231.5
|
B. |
268.8
|
C. |
287.5
|
D. |
313.6
|
向一定量的Fe,FeO,Fe2O3,Fe3O4的混合物中,加入150mL 4mol/L的稀硝酸,恰好使混合物完全溶解,并放出标准状况下NO气体2.24L,往所得溶液中加KSCN溶液,无红色出现。若用一定量的氢气在加热条件下还原相同质量的该混合物,所得固体的物质的量可能为
| A.0.30 mol | B.028mol | C.0.25mol | D.0.22 mol |
一种基于酸性燃料电池原理设计的酒精检测仪,电池反应的化学方程式为:CH3CH2OH + O2=CH3COOH + H2O。下列有关说法不正确的是
| A.检测时,电解质溶液中的H+向正极移动 |
| B.若有0.4 mol电子转移,则消耗2.24 L氧气 |
| C.正极上发生还原反应,负极上发生氧化反应 |
| D.负极上的反应为:CH3CH2OH - 4e- + H2O==CH3COOH + 4H+ |
造纸工业中常用Cl2漂白纸浆,漂白后的纸浆用NaHSO3除去残留的Cl2,其反应为:Cl2+NaHSO3+H2O=NaCl+H2SO4+HCl,在这个反应中,氧化产物与还原产物的物质的量之比为
| A.2︰3 | B.3︰1 | C.2︰1 | D.1︰2 |
将3.84g铜粉与一定质量浓硝酸反应,当铜完全作用时,收集到气体2.24L(标准状况下),则所消耗酸的物质的量是
| A.0.11mol | B.0.22mol | C.0.16mol | D.0.1mol |
足量铜溶于一定量浓硝酸,产生NO2、N2O4、NO的混合气体,这些气体若与1.12LO2(标准状况)混合后通入水中,气体被水完全吸收。若向原所得溶液中加入5 mol·L-1H2SO4溶液100 mL,则继续溶解的Cu的质量为
| A.6.4g | B.9.6g | C.19.2g | D.24g |
如图所示,图中四种装置工作一段时间后,测得导线上均通过了0.002mol电子,此时溶液的pH由小到大的排列顺序为(不考虑溶液的水解和溶液的体积变化)
| A.①<②<③<④ | B.①<③<②<④ |
| C.②<①<④<③ | D.①<②<④<③ |
将m g的铜放入足量的稀硝酸中充分反应后(铜反应完全),生成n L(标准状况)NO,则被还原的硝酸为
①63n/22.4 g ②n/22.4 g ③m/96 mol ④42m mol
| A.①④ | B.①③ | C.②④ | D.②③ |
用惰性电极电解一定量的硫酸铜溶液,电解一段时间后,向电解液加入0.1 mol碱式碳铜晶体(不含结晶水),恰好使溶液恢复到电解前的浓度和pH。下列有关叙述不正确的是
| A.电解过程产生的气体体积(在标准状况下)为5.6 L |
B.电解过程只发生了2CuSO4+2H2O 2Cu+O2↑+2H2SO4 2Cu+O2↑+2H2SO4 |
| C.电解过程转移的电子数为3.612×1023个 |
| D.加入的碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4====2CuSO4+CO2↑+3H2O |
如图所示是Zn和Cu形成的原电池,其实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
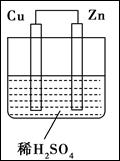

| A.①②③ | B.②④ | C.④⑤⑥ | D.③④⑤ |