Ⅰ、某化学反应的反应物和产物为:KMnO4 + KI + H2SO4 → MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是 。
(2)如果该反应方程式中I2和KIO3的系数都是5,KMnO4的系数是 。
(3)在给出的化学式上标出电子转移的方向和数目: KMnO4 + KI + H2SO4 →
(4)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是______________。
Ⅱ、向盛有KI溶液的试管中加入少许CCl4后滴加氯水, CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式:

(2)整个过程中的还原剂是 。
(3)把KI换成KBr,则CCl4层变为橙红色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。据此判断下列反应能否进行HBrO3+HCl→ Br2+Cl2+H2O(未配平) 。(填“能”或“否”)
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用Kl与Cl2反应制KIO3,至少需要消耗Cl2 L。(标准状况,保留2位小数)
工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO)。某化学小组在一定温度下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO3-等离子其物质的量(mol)与反应时间t(min)的关系曲线.下列说法错误的是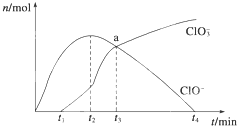
| A.参加反应所需NaOH与氯气的物质的量之比一定为2:1 |
| B.a点时溶液中n(NaCl):n(NaClO3):n(NaClO)=6:1:1 |
| C.t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-=2Cl-+ClO3- |
| D.使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸 |
在1000 mL含有等物质的量的HBr和H2SO3溶液中通入0.01 molCl2,有一半 变为Br2,原溶液中HBr和H2SO3的浓度都等于
变为Br2,原溶液中HBr和H2SO3的浓度都等于
A.0.007 5 mol· |
B.0.008 mol· |
C.0.075 mol· |
D.0.08 mol· |
根据表中信息判断,下列选项不正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2 、H2SO4 |
K2SO4、MnSO4...... |
| ② |
Cl2、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4-... |
Cl2、Mn2+、H2O |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2与 FeBr2的物质的量之比为1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4-> Cl2 > Fe3+ > Br2
已知S2O8n-离子和H2O2一样含有过氧键,因此也有强氧化性,S2O8n-离子在一定条件下可把Mn2+氧化成MnO4-离子,若反应后S2O8n-离子生成SO42-离子;又知反应中氧化剂与还原剂的离子数之比为5:2,则S2O8n-中的n值和S元素的化合价是
| A.2, +6 | B.2, +7 | C.4 ,+6 | D.4 , +7 |
将3.48gFe3O4完全溶解在100mL 1mol·L-1 H2SO4溶液中,然后加入K2Cr2O7溶液25mL,恰好使溶液中的Fe2+全部反应完,Cr2O72-全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度为
| A.0.033mol·L—1 | B.0.3mol·L—1 | C.0.2mol·L—1 | D.0.1mol·L—1 |
聚合硫酸铝铁[AlaFeb(OH)n(SO4)m·xH2O]是一种新型高效净水剂,广泛应用于工业污染水的处理。
(1)聚合硫酸铝铁能够净水的原因是
(2)AlaFeb(OH)m(SO4)n•xH2O中a、b、m、n的代数关系式为_______________________。
(3)为了测定聚合硫酸铝铁的组成,进行如下实验:
步骤一:准确称取8.810g样品溶于150mL 0.100mol•L-1稀硫酸,恰好完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体10.485g;
步骤二:另取相同质量的样品,溶于过量的氢碘酸,以磁力搅拌机搅拌,充分反应后,以0.500mol•L-1Na2S2O3溶液滴定至浅黄色,滴入几滴淀粉溶液,再滴定至终点,消耗Na2S2O3溶液20.00mL.(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
①步骤二中使用磁力搅拌器进行搅拌的目的是________________________。
②通过计算确定聚合硫酸铝铁的化学式(写出计算过程)。
在含有nmolFeI2的溶液中通入Cl2,有xmolCl2发生反应,下列说法正确的是( )
| A.当x≤0.5n时,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl- |
| B.当x≥n时,反应的离子方程式为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
| C.当Fe2+和I-都被氧化时,x的最小值须大于0.5n |
| D.当x=n时,反应后氧化产物的物质的量为nmol |
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸的冶炼钢铁的重要原料。高温下可发生反应:其中一个反应为:3FeS2+8O2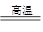 6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
(2)氯化铝溶液显酸性,原因是_________________________(用离子方程式稀释);
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素(CO(NH2)2;它易被氧化),原理如下图所示。
①电源的负极为_________(填“A”或“B”)。
②阳极室中发生的反应依次为_________、_________。
③电解结束后,阴极室溶液的pH与电解前相比将_________;若阴极共收集到气体6.72L(标准状况),则除去的尿素为________ g(忽略气体的溶解)。
(4)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2。已知:2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•moL-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•moL-1
H2O(g)═H2O(l)△H=-44.0kJ•moL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:_________。
在100 mL含等物质的量的HBr和H2SO3的溶液中通入0.025 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。则原溶液中HBr和H2SO3的浓度都等于
| A.0.16 mol·L-1 | B.0.02 mol·L-1 | C.0.20 mol·L-1 | D.0.25 mol·L-1 |
a mol FeS与b mol FeO投入到v L、c mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④[cV-(9a+b)/3 ]mol
| A.①④ | B.②③ | C.①③ | D.②④ |
标准状况下,将a L H2和Cl2的混合气体点燃,充分反应后,将混合气体通入含b mol NaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO,且三者物质的量之比为8∶1∶1,则原混合气体中H2的物质的量为( )
| A.a/2 mol |
| B.(a/22.4-b)mol |
| C.(a/22.4-b/2)mol |
| D.b/2 mol |
实验室将NaClO3和Na2SO3按物质的量为2:1放入烧杯中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X的化学式为( )
| A.Cl2 | B.Cl2O | C.ClO2 | D.Cl2O3 |
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2 → H2O IO3- → I2 MnO4- → Mn2+ HNO3 → NO如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是:
| A.H2O2 | B.IO3- | C.MnO4- | D.HNO3 |