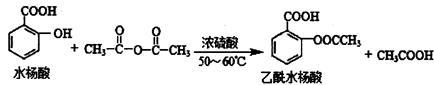
工业上常用水杨酸与乙酸酐反应制取解热镇痛药阿司匹林(乙酰水杨酸)。
【反应原理】

【物质性质】

【实验流程】
(1)物质制备:向大试管中依次加入2 g水杨酸、5 mL乙酸酐(密度为1.08g/mL)、5滴浓硫酸,振荡大试管至水杨酸全部溶解,将其放入盛有热水烧杯中,固定在铁架台上,在85℃~90℃条件下加热5~10 min。装置如下图:

(2)产品结晶:取下大试管,置于冷水中冷却10 min。待晶体完全析出,……抽滤,再洗涤晶体,抽干。
(3)产品提纯:将粗产品转移至150 mL烧杯中,向其中慢慢加入试剂NaHCO3并不断搅拌至不再产生气泡为止。进一步提纯最终获得乙酰水杨酸1.8 g。
(4)纯度检验:取少许产品加入盛有5 mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色。
【问题讨论】
1、写出水杨酸与碳酸氢钠溶液反应的化学反应方程式 。
2、写出水杨酸与足量碳酸钠溶液反应后含苯环的生成物的结构简式 。
3、流程(1)装置图中长导管的作用 。
4、控制反应温度85℃~90℃的原因 。
5、流程(2)中证明晶体洗涤干净的操作方法: 。
6、流程(4)中溶液显紫色,可能的原因是 。
7、1mol乙酰水杨酸与氢氧化钠溶液反应可能,最多消耗 mol NaOH。
8、实验中乙酰水杨酸的产率为 (已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180)。
自来水生产的流程示意图见下:
⑴ 混凝剂除去悬浮物质的过程 (填写序号)
①只是物理变化 ②只是化学变化 ③是物理和化学变化
FeSO4·7H2O是常用的混凝剂,它在水中最终生成 沉淀。
⑵ 实验室过滤操作所用到的玻璃仪器是 。
⑶ 我们有时感觉自来水“有漂白粉气味”是因为使用了氯气消毒,请写出有关的化学反应方程式 。
下列物质中, 可以作为氯气的代用品。(填写序号)
① 臭氧 ②NH3(液) ③K2FeO4 ④SO2
⑷ 有些地区的天然水中含有较多的钙、镁离子。用离子交换树脂软化硬水时,先后把水通过分别装有 离子交换树脂和 离子交换树脂的离子交换柱。(填“阴”或“阳”)
⑸ 测定水中的溶解氧:量取20mL水样,迅速加入MnSO4和KOH混合溶液,再加入KI溶液,立即塞好塞子,振荡使完全反应。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。用0.10mol/LNa2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液。已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+。
上述过程发生的反应可表示为:2Mn2++4OH-+O2=2MnO(OH)2
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O I2+2S2O32-=2I-+S4O62-
求水中的溶解氧量(以mg·g-1为单位)
⑴近年来我国出现大范围雾霾天气,许多城市发布PM2.5重度污染警报。
①下列行为不会增加城市大气中PM2.5浓度的是 (填字母)。
a.燃放烟花爆竹 b.为城市主干道洒水保洁 c.露天焚烧落叶
②雾霾会刺激呼吸道,使人易患流行性感冒。感冒发烧病人可服用 药品进行治疗(填字母)。
a.麻黄碱 b.抗酸药 c.阿司匹林
③多食富含维生素C的蔬菜水果可增强人的免疫力。维生素C的结构简式是 ,它的分子式是 。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有 性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是 ,说明维生素C具有 性。
,它的分子式是 。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有 性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是 ,说明维生素C具有 性。
⑵今年1月12日,我国3名潜水员圆满完成首次300米饱和潜水作业,实现“下五洋捉鳖”的壮举。
①潜水员乘坐的潜水钟以钢铁为主要制造材料。钢铁容易在潮湿空气中发生电化学腐蚀,其负极的电极反应式是 。
②潜水员需要均衡的膳食结构。糖类、油脂、蛋白质都能为人体提供能量。某品牌高钙梳打的配料标签如图所示。在所列配料中,富含糖类的是 ,植物油在体内水解最终产物是高级脂肪酸和 。碳酸氢钠、碳酸钙可调节人体内的过多的胃酸,写出碳酸钙与胃酸反应的离子方程式为 。
③运载潜水钟的母船会产生大量废水和垃圾。科学实验的含汞离子废水 需要处理后再排放,可加入适量的硫化钠溶液,使汞离子变成 (填化学式)沉淀而除去;
⑶著名物理化学家张存浩院士获得2013年国家最高科学技术奖,他在氟化氢(氘)激光器和水煤气合成液体燃料研究等方面做出了重要贡献。
①氟化氢(HF)的水溶液能雕刻玻璃。制备普通玻璃的主要原料有SiO2、CaCO3、 (填化学式)。
②水煤气的主要成分是CO和H2,在40MPa、380℃、锌铬氧化物做催化剂的条件下,用CO和H2合成液体燃料CH3OH,该反应的化学方程式为 。
⑷材料的不断发展可以促进社会进步。
① “玉兔”号月球车开创了我国月球表面探索的先河,其制备材料中
使用了镁铝合金,选用镁铝合金的优点是 (任答一点)。
②碳化硅硬度很大,它属于 (填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
③随便丢弃用过的聚乙烯塑料膜会造成白色污染,写出由乙烯在催化剂作用下制备聚乙烯的化学方程式 ;
合理使用药物是保证身心健康、提高生活质量的有效手段。药物化学已经成为化学的一个重要领域。
(1)我国科学家屠呦呦因发现治疗疟疾的特效药——青蒿素,而获得2015年诺贝尔生理学或医学奖。青蒿素的结构简式如右图所示,其含有的过氧基(—O—O—)具有强氧化性。

请回答下列问题:
①青蒿素的分子式为_______________________。
②下列有关青蒿素的叙述中,正确的是__________(填字母)。
A、青蒿素属于芳香族化合物
B、青蒿素具有强氧化性,可用于杀菌
C、青蒿素分子中的所有碳原子在同一个平面上
D、在一定条件下,青蒿素能与NaOH溶液发生反应
(2)阿司匹林(乙酰水杨酸)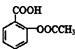 是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:
是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:
请回答下列问题:
①乙酰水杨酸中的含氧官能园的名称为____________________。
②制得的阿司匹林中常含有少量的杂质水杨酸,下列试剂可用于检验阿司匹林样品中是否混有水杨酸的是________________(填字母)。
A、碳酸氢钠溶液 B、三氯化铁溶液 C、石蕊试液
③写出水杨酸与足量的NaHCO3溶液完全反应所得有机产物的结构简式:_____________。
④1 mol乙酰水杨酸与足量的NaOH溶液反应,最多消耗NaOH物质的量为_________mol。
汞不溶于水,易挥发,易与许多金属形成合金,汞是对人体危害较大的一种金属,据统计世界上有80多种工业以汞为原料,生产过程中产生的汞的污染越来越引起人们的重视,水体中的无机汞主 要有Hg2+、Hg22+。
(1)实验时倘若不慎,将汞溅落地面时,可先用涂上X溶液的锌片去粘拾,然后再用足量的X溶液 溶解锌片回收汞,X溶液可以是 (填试剂名称)
(2)检测水体中的Hg2+可用KI及CuSO4溶液与其反应生成橙红色Cu2HgI4沉淀,用漫反射光谱直接测定汞沉淀物,该反应的离子方程式可表示为
(3)冶金厂治理含汞、含硫的烟气并回收汞,中国冶金工作者在研究“Hg-I-H2O”系热力学的基础上,查明KI溶液能有效吸收汞,吸收总反应为:2Hg+SO2+8I-+4H+ =2HgI42-+S+2H2O,最后进行电解法电解吸收液(K2HgI4),阴极的电极反应式为
(4)国家制定的工业废水排放标准:汞的含量≤0.05 mg/L。某合作学习小组的同学拟用硫化钠法处理含汞废水,其步骤为:先将溶液pH调至8~10,然后加入稍过量的硫化钠溶液,最后加入一定量的FeSO4溶液,过滤后排放。已知:25℃HgS的Ksp= 4×10-52;Hg2S的Ksp=1.0×10-47,FeS 的Ksp=6.3×10-18;HgS+Na2S Na2HgS2(易溶)。
Na2HgS2(易溶)。
①若操作程序完全正确,且废水中只含无机汞,上述处理后的废水能否达标排放 (选填:“能”或“不能”)
②加入FeSO4溶液的作用(写出两项)
吊白快化学式:NaHSO2·CH2O·2H2O ,白色块状或结晶性粉粒,溶于水,为一种化工原料。在水中吊白块能水解生成甲醛和次硫酸氢钠(NaHSO2结构 Na+[O-S-O-H ]-)。不法分子常利用其泡制腐竹、水发食品等。添加了吊白块的食品除甲醛毒性外,残存的NaHSO2在烹调中会产生剧毒二氧化硫,导致呼吸道过敏,严重伤害人体健康。
(1)工业上生产吊白快的反应原理可用以下两个方程式表示:
_Zn+_NaHSO3→_Na2S2O4+_Na2Zn(SO3)2+_H2O
Zn+ZnS2O4+2Na2CO3+2CH2O+6H2O→2(NaHSO2·CH2O·2H2O)+2ZnCO3↓+2NaOH
配平第一个方程式并指出硫元素在两个反应中化合价变化。
(2)次硫酸氢钠可与氢氧化钾溶液反应,试写出反应的离子方程式:
(3)吊白块能保鲜防腐是利用了 ,能漂白有色物质是利用了 。
某自来水厂利用河水处理成自来水的工艺流程示意图如下图所示:
提供的试剂:饱和Na2CO3溶液、NaOH溶液、生石灰、CCl4、BaCl2溶液、KOH溶液
(1)为除去水中含有的Ca2+、Mg2+、HCO3-、Cl-、SO42-,试剂a代表两种化学物质,主要是除去水中SO42-、Mg2+和HCO3-,这两种试剂是________和________(只填化学式)。
(2)凝聚剂A常用FeSO4·7H2O,最终生成红褐色胶体沉淀,该胶状沉淀的化学式为________,可以除去其中的悬浮固体颗粒,该过程是________(填序号)。
A.只有物理变化,无化学变化
B.只有化学变化,无物理变化
C.既有化学变化,又有物理变化
(3)通入CO2的目的是__________和__________。
(4)传统的氧化剂是Cl2,现代工艺用ClO2取代Cl2,通入ClO2的作用是________________________;优点是________________________________。
(5)离子交换柱X、Y中有一种是H+型交换柱,另一种是OH-型离子交换柱,目的是除去水中残留的杂质离子,则X应是哪种交换柱?________(填“H+型”或“OH-型”);如果两个交换柱位置颠倒会产生什么后果?_______________________________________
________________________________________________________________________。
(1)当胃发生病变时,会出现很多症状,如胃部疼痛等。如果只是由于胃酸过多引起的,则可使用抗酸药进行治疗。现有一种抗酸药的有效成是Mg(OH)2,试写出这种物质与胃酸(以HCl表示)作用的化学方程式 。
(2)有一种抗酸药,其有效成分是CaCO3,为测定每一片药片中CaCO3的含量,现取一片药片,研成粉末,再与足量盐酸反应,收集到标准状况下的CO2气体22.4mL。则①CaCO3与足量盐酸反应的化学方程式为 ;②每一片药片中CaCO3的质量为 g。
下列说法错误的是
| A.抗酸药能中和胃里过多的盐酸,缓解胃部不适 ,是一类治疗胃痛的药 |
| B.碳酸镁、碳酸钡都能制成抗酸药 |
| C.青霉素有阻止多种细菌生长的优异功能,虽经1×107倍稀释,仍有疗效 |
| D.青霉素是重要的消炎药 |
我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO3),据此回答下列问题:
(1)碘是合成下列哪种激素的主要原料之一( )
A、胰岛素
B、甲状腺素
C、生长激素
D、雄性激素
(2)长期生活在缺碘山区,又得不到食盐供应,易患( )
A、甲状腺亢进
B、贫血症
C、地方性甲状腺肿
D、糖尿病
(3)可用盐酸酸化的碘化钾淀粉溶液,检查食盐中含碘酸钾。反应的化学方程式为 。可观察到的明显现象为 。
有一种抗酸药,其主要成分为碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁,试就该抗酸药的成分回答下列问题:
(1)在以上成分中,属于两性氢氧化物的是 。(填化学式)
(2)试写出该两性氢氧化物与盐酸溶液反应的化学方程式: 。
复方铝酸铋片是一种抗酸药,每片中含铝酸铋200mg ,碳酸镁400mg,碳酸氢钠200mg,甘草流浸膏粉300mg,弗朗鼠李皮25mg 。
(1)该抗酸药的有效成分是 (用化学式表示)
(2)请写出其有效成分与盐酸反应的化学方程式(任写一个)
化学与生产、生活密切相关。下列叙述正确的是
| A.六水氯化钙可用作食品干燥剂 |
| B.生石灰作干燥剂是物理变化 |
| C.为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 |
| D.“血液透析”利用了胶体的性质 |