(1)指出配合物K2[Cu(CN)4]的配离子、中心离子、配位体、配位数:______________________。
(2)在[Fe(CN)6]3-中,中心原子的配位数为__________,配体的立体构型是__________。
(3)配合物[Cr(H2O)4Br2]Br·2H2O中,中心原子的化合价为__________,内界的电荷数为__________。
I.下列各组物质:
① 、
、 、
、 ②石墨和C60 ③水和冰
②石墨和C60 ③水和冰
④正戊烷和异戊烷 ⑤35Cl2、37Cl2
其中,
(1)属于同分异构体的是 (填序号,下同)
(2)属于同素异形体的是
(3)属于同位素的是
II.下列6种固态物质:①P4 ②SiO2 ③NH4Cl ④NAF ⑤CO2(干冰) ⑥金刚石,
回答下列问题:
(1)熔化时不需要破坏化学键的化合物是 (填序号,下同)
(2)熔化时需要破坏共价键的单质是
(3)含有共价键的离子化合物是
(7分)现有下列物质:①干冰;②氢氧化钠;③过氧化氢;④晶体硅;⑤过氧化钠;⑥醋酸钠;⑦溴化铵;⑧氖;⑨碘晶体;请用编号填写下列空白。
(1)只含极性键的物质有 。
(2)只含非极性键的物质有 。
(3)只含极性键和非极性键的物质有 。
(4)只含离子键和极性键的物质有 。
(5)只含离子键和非极性键的物质有 。
(6)既含离子键,又含极性键和非极性键的物质有 。
(7)不含化学键的物质有 。
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,用ClO2替代Cl2对自来水进行消毒是城市饮用水处理新技术。工业上制备ClO2的方法很多,可以用合适的还原剂还原NaClO3制得。
(1)在硫酸酸化的条件下用 草酸还原NaClO3制ClO2,其反应的化学方程式为 。
(2)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O。
①写出第二步反应的离子方程式 。
②工业生产时需在反应物中加少量Cl-,其作用是 。
(3)ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐,写出ClO2与NaOH溶液反应的离子方程式 。
(4)ClO2可用于含CN-废水的处理,产生的两种气体可以直接排入空气。
①已知CN-中C、N的最外层都满足8电子结构,写出CN-的电子式 。
②写出该反应的离子方程式 。
氮化钠(Na3N)是科学家制备的一种重要化合物。它与水作用可生成NH3 和一种强碱。回答下列问题:
(1)氮化钠的电子式是 ,该化合物是 化合物(选填“离子”、“共价”)。
(2)氮化钠与水反应的化学方程式是 ,该反应属于 反应。
(3)氮化钠与盐酸反应生成 种盐,其中 (填盐的化学式)既含离子键又含有共价键。
(4)氮化钠中两种微粒的半径大小比较:r(Na+) r(N3-)(填“大于”、“小于”或“等于”)。
化学上常用一条短线来表示一对共用电子对,用元素符号和短线来表示物质结构的式子叫结构式,例如Cl2的结构式用Cl-Cl表示,H2O的结构式用H-O-H表示。
(1)写出下列物质的结构式:
①CO2 ②N2 ;③CH4 ;④C2H4 。
(2)根据下列物质的结构式写出其相应的电子式:
①H―O―Cl_____; ②H-O-O-H_______;
③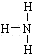 _____; ④H-C≡C-H 。
_____; ④H-C≡C-H 。
(1)写出氯原子的原子结构示意图 ,NH4Cl的电子式 ;
(2)用电子式表示H2O的形成过程 ;
(3)已知一定条件下,白磷转化为红磷释放出能量,则等质量的白磷比红磷具有的能量 (填“高”、“低”),故白磷比红磷稳定性 (填“强”、“弱”),等质量的白磷和红磷充分燃烧均生成五氧化二磷, 放出热量多。
用电子式表示下列物质的形成过程:
(1)CO2 ;
(2)NaCl 。
X、Y、Z、W是原子序数依次增大的短周期元素,X元素的族序数是周期序数的2倍;Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素最高化合价与最低化合价绝对值之差等于4;W元素在周期表中位于非金属性最强的元素下方。请回答:
(1)X元素在周期表中的位置是 ;W-离子的结构示意图为 。
(2)X元素可形成多种气态氢化物,其中相对分子质量为26的气态氢化物的电子式为 ;25℃、101kPa时该气态氢化物热值为5×104 kJ•kg-1,则其标准燃烧热为 。
(3)写出一种适宜实验室制取W单质的离子方程式: 。
(4)室温时金可溶于王水(浓盐酸和浓硝酸混合物)生成HAuCl4,若反应过程中消耗的氧化剂与还原剂物质的量相等,则该化学方程式为 。
(共10分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
|
|
(1)在这些元素中,化学性质最不活泼的是: (填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_____________,碱性最强的化合物的电子式是:_____________。
(3)最高价氧化物是两性氧化物的元素是________;写出它的氧化物与氢氧化钠反应的离子方程式______。
(4)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。
(5)表示①与⑦的化合物的电子式 ,该化合物是由 (填“极性”或“非极性”)键形成的。
某些化学键的键能如下表(kJ·mol—1):

(1)根据上表数据判定,H2和Cl2较稳定的是 ;
(2)1 mol H2在足量C12中燃烧,放出热量 kJ。
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ;砷与溴的第一电离能较大的是 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ,与其互为等电子体的一种分子为 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为 ,As原子采取 杂化。
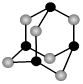
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 个Ga相连,As与Ga之间存在的化学键有 (填字母)。
| A.离子键 | B.σ键 | C.π键 | D.氢键 E.配位键 F.金属键 G.极性键 |
五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。D周期序数等于D原子最外层电子数。E原子半径是同周期中最小的(除稀有气体外)根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写),其中D的最高价氧化物是 氧化物。
(2)乙物质中存在的化学键类型是 。
(3)化合物乙的电子式 。
(4)写出C与D的最高价氧化物对应的水化物反应的离子方程式 。
(5)E的单质通入C的最高价氧化物对应的水化物的溶液中反应生成的“84”消毒液的主要成分的化学式为 。
(1)在CaCl2、KOH、CO2、H2SO4、Na2O2、Na2S中含有离子键的是__________,只含共价键的是__________,既含有离子键又含有共价键的是_____________。
(2)书写下列物质的电子式,
NH4Cl________, CO2__________,
推断题科学家们在探索生命奥妙过程中,认识到生命细胞的组成和元素周期律有密切的关系,约占人体质量99.97%的11种大量元素全部位于周期表前20号元素,其余的是十多种人体不可缺少的微量元素。现有a~g 7种短周期元素,是氧、硫、钾、钙外的其它大量元素,它们在元素周期表中的位置如下,并据此回答下列问题:
| a |
|
|
|||||
| |
|
|
d |
e |
|
|
|
| b |
c |
|
|
f |
|
g |
|
(1)元素的原子间最容易形成离子键的是下列中的 (填选项),元素的原子间最容易形成共价键的是下列中的 (填选项)。
A、c和f B、b和g C、d和g D、b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的是 (填选项)
A、ea3 B、ag C、fg3 D、dg4