在①HF、②H2S、③BF3、④CS2、⑤CCl4、⑥N2、⑦SO2分子中:
(1)以非极性键结合的非极性分子是___________
(2)以极性键相结合,具有直线型结构的非极性分子是___________
(3)以极性键相结合,具有正四面体结构的非极性分子是___________
(4)以极性键相结合,而且分子极性最大的是___________
(1)菠菜营养丰富,素有“蔬菜之王”之称,在营养价值上是一种高效的补铁剂。某化学小组欲设计实验方案,探究菠菜中是否存在铁元素与草酸及可溶性草酸盐。甲同学查阅资料得知:草酸又名乙二酸,化学式为H2C2O4,是一种二元有机弱酸,具有较强的还原性。甲同学依据上述信息推测,菠菜中 铁元素呈 价,其理由是 。甲同学同时设计实验方案,验证其推测是否正确。请简述实验方案 。
铁元素呈 价,其理由是 。甲同学同时设计实验方案,验证其推测是否正确。请简述实验方案 。
(2)乙炔 是有机合成工业的一种原料。工业上曾用
是有机合成工业的一种原料。工业上曾用 与水反应生成乙炔。
与水反应生成乙炔。
① 中
中 与
与 互为等电子体,
互为等电子体, 的电子式可
的电子式可 表示为 ;1mol
表示为 ;1mol  中含有的
中含有的 键数目为_ 。
键数目为_ 。
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为_ 。
氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为个.
(2)分子内的
键、分子间的范德华力和氢键从强到弱依次为。
 沸点比
沸点比 高,原因是.
高,原因是.
(3)可与
形成
,
中
原子采用杂化。
中
键角比
中
键角大,原因为。
(4)与
的晶胞同为面心立方结构,已知
晶体密度为ag
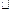 cm-3,
cm-3,表示阿伏加德罗常数,则
晶胞体积为Cm3。
(5分)有下列几种物质:①Ne ②NH4Cl ③NaOH ④Cl2 ⑤KNO3⑥CO2 ⑦H202 ⑧Na2O2
属于共价化合物得是 (填序号,下同),只存在极性键的是 ,既存在极性键又存在非极性键的是 ,既存在极性键又存在离子键的是 ,既存在离子键又存在非极性键的是 。
H2O2、KCl、NaOH、Na2O2、HCl、O2中只含离子键的是 ,只含极性键的是 ,只含非极性键的是 ,既含离子键又含极性键的是 ,既含离子键又含非极性键的是 ,既有极性键又有非极性键的是 。
有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2,⑧H2O2,⑨HCN(H—C≡N);
只含有极性键的是__________;只含有非极性键的是__________;既有极性键,又有非极性键的是______________;只有σ键的是____________;既有σ键又有π键的是__________;含有由两个原子的s轨道重叠形成的σ键的是__________;含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是____________;含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是__________。
用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型
| 分子或离子 |
PbCl2 |
XeF4 |
SnCl62- |
PF3Cl2 |
Hg Cl42- Cl42- |
ClO4-- |
| 空间 构型 |
|
|
|
|
|
|
(4分)下列六种物质的变化中,将合适序号填写在下列空白中:
①干冰的升华; ②硫酸钾熔化; ③NaCl溶于水; ④HCl溶于水; ⑤液氨的受热蒸发; ⑥Na2O2溶于水
(1)仅需要克服分子间作用力的是 。(2)发生离子键破坏,又发生共价键破坏的是 。(3)发生共价键破坏的是 。(4)发生离子键破坏的是 。
下面是我们熟悉的物质: ①O2 ②金刚石 ③NaBr ④H2SO4 ⑤NaOH ⑥NH4Cl ⑦Na2O2 ⑧Ne
(1)请用序号填空:这些物质中,只含共价键的是 ;只含离子键的是 ;不存在化学键的是 ;
(2)Na2O2中阴、阳离子数目之比是 ,NaOH的电子式为 。
三种常见元素结构信息如下表,试根据信息回答有关问题:
| 元素 |
A |
B |
C |
| 结构信息 |
基态原子核外有两个电子层,最外层有3个未成对的电子 |
基态原子的M层有1对成对的p电子 |
基态原子核外电子排布为[Ar]3s104sx,有+1、+ 2两种常见化合价 2两种常见化合价 |
(1)写出B原子的基态电子排布式 ;
(2)用氢键表示式写出A的氢化物溶液中存在的氢键 (任写一种);A的氢化物分子结合一个H+形成阳离子后,其键角 (填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 ;
(4)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。
在以上分子中,中心原子采用 杂化形成化学键是 (填写序号);在②的分子中有 个
杂化形成化学键是 (填写序号);在②的分子中有 个 键和 个
键和 个 键。
键。
水是自然界中普遍存在的一种重要物质,根据下列信息回答问题:
(1)氧原子基态时价层电子的电子排布图为____________。
( 2)已知2H2O
2)已知2H2O 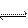 H3O+ + OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
H3O+ + OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
(3)下列关于水的说法正确的是__________(选填序号)。
①在冰晶体中每一个水分子内含有两个氢键;
②水分子是由极性键构成的极性分子;
③水在化学反应中可以作氧化剂,也可以 作还原剂;
作还原剂;
④水分子中既含σ键,又含有π键;
⑤纯水呈中性,所以在任何条件下纯水的PH 均为7;
均为7;
⑥水分子中的氧原子的杂化类型是SP3杂化,价层电子对数是2。
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低。
稳定 性: 沸点:
性: 沸点:
(4分)在下列化合物中:H2O、Na2O、I2、、N aCl、、KOH、CO2、NH4Cl、Na2O2,请填空:
aCl、、KOH、CO2、NH4Cl、Na2O2,请填空:
(1)只由非金属组成的离子化合物是 ,
(2)含有极性共价键的离子化合物是 ,
(3)只含有非极性共价键的是 ,
(4)既有离子键又有非极性键的化合物是 。
下列是中学化学常见的物质
A.金刚石 B.HCl C.NaCl D.Na2 SO4 E.Na2S F .He G.N2
请用序号回答(1)-(4)题:
(1)这些物质中只含共价键的是
(2)既含离子键又含共价键的是
(3)固态时属于离子晶体的是
(4)熔化时需克服共价键的是
(5)试写出E. G的电子式:
在下列物质中:① CO2 ② KCl ③ CaBr2 ④ O2 ⑤ NH4Cl ⑥ Ca(OH)2 ⑦ N2 ⑧ HBr ⑨ NH3 ⑩ Na2O2
(1)有离子键也有非极性键的是 (2)属于离子化合物的是
(3)只有非极性键的是 (4)只有离子键的是