下列化学用语使用正确的是
A.中子数为9的氧原子符号为16O
B.某元素的一种原子质量数为X则该元素的相对原子质量为X
C.H、D、T三种核素化学性质不相同
D.次氯酸的结构式:H—O—Cl
下列物质的熔点均按由高到低的次序排列,其原因是由于键能由大到小排列的是
| A.钠、干冰 | B.金刚石、晶体硅 |
| C.碘化氢、溴化氢 | D.二氧化硅、二氧化碳 |
分子模型可以直观地表现分子结构的特点。下图表示某烃分子的一种模型,有关说法中正确的是
| A.该图表示的是乙烯分子的球棍模型 |
| B.该烃分子是非极性分子 |
C.该烃的电子式为: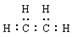 |
D.该烃分子中半径较大的原子其核外电子排布的轨道表示式为: |
科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2 HCOONa+H2O,下列有关说法正确的是
HCOONa+H2O,下列有关说法正确的是
| A.储氢过程中,NaHCO3被氧化 |
| B.释氢过程的本质是盐类的水解 |
| C.储氢、释氢过程均无能量变化 |
| D.HCOONa晶体中既含有离子键又含有共价键 |
运用有关概念判断下列说法正确的是
| A.NH4Cl中有离子键,是离子化合物 |
| B.46g C2H5OH燃烧放出的热量为乙醇的燃烧热 |
C.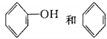 互为同系物 互为同系物 |
| D.绿色化学的核心是应用化学原理对环境污染进行治理 |
下列说法正确的是( )
| A.同一主族元素气态氢化物从上到下,其沸点逐渐升高 |
| B.非金属单质中一定存在共价键,离子化合物中可能存在共价键 |
| C.非极性键不可能存在于离子化合物中,由非金属元素组成的化合物中一定不存在离子键 |
| D.含有阴离子的物质一定含有阳离子 |
σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成。则下列分子中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠构建而成的是
| A.H2 | B.Cl2 | C.NaH | D.HF |
金属键的强弱与金属价电子数的多少有关,价电子数越多金属键越强,与金属阳离子的半径大小也有关,金属阳离子的半径越大,金属键越弱。据此判断下列金属熔点逐渐升高的
| A.Li Na K | B.Na Mg Al | C.Li Be Mg | D.Li Na Mg |
下列说法正确的是 ( )
| A.Na2O2、NaClO中所含化学键类型完全相同 |
| B.只有活泼金属元素与活泼非金属元素之间才能形成离子键 |
| C.等物质的量的CN-和N2含有的共用电子对数相等 |
| D.氯气与NaOH反应的过程中,同时有离子键、极性键和非极性键的断裂和形成 |
下列物质:①BeCl2 ②SiC ③白磷 ④BF3 ⑤NH3 ⑥过氧化氢 , 其中含极性键的非极性分子是
| A.①③④ | B.②③⑥ | C.①④ | D.①③④⑤ |
下列叙述中,正确的是
| A.1s电子云界面图是一个球面,电子云中的每个小黑点代表一个电子 |
| B.NaH中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠形成的 |
| C.对于组成结构相似的分子,一定是相对分子质量越大,熔、沸点越高 |
| D.在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析 |
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
| A.NH4Cl=NH3↑+ HCl↑ | B.NH3+CO2+H2O=NH4HCO3 |
| C.2NaOH+Cl2=NaCl+NaClO+H2O | D.2Na2O2+2CO2=2Na2CO3+O2 |