氯元素是生产生活中常见的非金属元素。
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式 ;不直接用Cl2作漂白剂的原因是 (写出两条)。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
a.臭氧 b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
①NaCl和Cl2中化学键的类型分别是 和 。
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③已知:
2H2O2(l)  2H2O(l)+O2(g) ΔH1 =-196.46 kJ·mol-1
2H2O(l)+O2(g) ΔH1 =-196.46 kJ·mol-1
H2(g)+1/2O2(g)  H2O(l) ΔH2 =-285.84 kJ·mol-1
H2O(l) ΔH2 =-285.84 kJ·mol-1
Cl2(g)+H2(g)  2HCl(g) ΔH3 =-184.60 kJ·mol-1
2HCl(g) ΔH3 =-184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。
(本题15分)卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)溴的基态原子的价电子排布图为___________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是____________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___________。
| 元素名称 |
氟 |
氧 |
溴 |
碘 |
铍 |
| 第一电离能(kJ/mol) |
1681 |
1251 |
1140 |
1008 |
900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大,这是由于溶液中发生下列反应:I-+I2
 。
。 的中心原子周围的σ键电子对对数为__________,孤电子对对数为_________。
的中心原子周围的σ键电子对对数为__________,孤电子对对数为_________。
(6)写出一个ClO2-的等电子体:_________________。
(Ⅰ)某钠盐溶液中通入足量氨气,无明显现象。再在所得溶液中通入过量CO2,产生大量白色沉淀。
(1)写出氨气的电子式 。
(2)该钠盐溶液中一定不可能含有下列哪种微粒 (填编号)。
| A.Cl- | B.Fe2+ | C.SiO32- | D.AlO2- |
(3)写出一个通入过量CO2时生成白色沉淀的离子方程式 。
(Ⅱ)电镀工业中往往产生大量的有毒废水,必须严格处理后才可以排放。某种高浓度有毒的含A离子(阴离子)废水在排放前的处理过程如下:
已知:9.0g沉淀D在氧气中灼烧后,产生8.0g黑色固体,生成的气体通过足量澄清石灰水时,产生10.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标况下密度为1.25g/L的气体1.12L。
(4)沉淀D的化学式是 。
(5)写出沉淀D在氧气中灼烧发生的化学方程式 。
(6)滤液C中还含有微量的A离子,通过反应②,可将其转化为对环境无害的物质,试用离子方程式表示该原理 。
(7)反应①为制得某种元素的低价X离子,试从氧化还原反应的角度分析,是否可以用Na2SO3溶液来代替B溶液 ,
并设计实验证明所用Na2SO3溶液是否变质 。
短周期A、B、C、D 4种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上电子数之和。
(1)A的原子结构示意图是___________ E的电子式为___________;
(2)D在周期表中的位置是 ______。它的下一周期同族元素最高价氧化物对应的水化物的分子式为___________;
(3)C与水反应的化学方程式是_________________________________,写出所得溶液中含有10个电子的微粒符号___________。
五种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X |
Y |
|
|
| |
Z |
W |
M |
请按要求回答下列问题:
(1)X元素名称 ,W的离子结构示意图 ;
(2)元素Z位于周期表中的位置是 ;
(3)元素Z可以形成多种单质,请任意写出一种常见单质的名称 ;
(4)Y的最高价氧化物的化学式为____ _;M的最高价氧化物水化物名称为_______;
(5)Z、W、M三种元素中,原子半径最大的是 (填元素符号);这三者与氢元素形成的化合物中,最稳定的是 (填:氢化物的化学式),它的电子式为 ;
(6)X与M可形成XM4型化合物,是一种常见的溶剂,其中的化学键类型是 (填:“离子键”或“共价键”)。
(7)W的氧化物有两种A和B,已知在某一定条件下,A和B能同时相互转化。则在该条件下A 完全转化为B(填:“能”或“不能”)
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。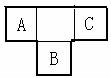
(1)B元素位于元素周期表中第 周期,第 族。
(2)由元素C与Mg元素形成的化合物的化学键的类型 。
(3)由元素A与氢元素形成的化合物的结构式 。
(4)由元素B与氢元素形成的化合物的电子式 。
(5)写出A的气态氢化物与B的最高价氧化物对应的水化物反应的化学方程式: 。
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。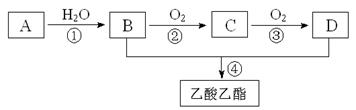
回答下列问题:
(1)写出A的电子式___________。
(2)B、D分子中的官能团名称分别___________、___________。
(3)写出下列反应的反应类型:①___________,②___________,④___________。
(4)写出下列反应的化学方程式:
① 。
② 。
④ 。
现有A、B、C、D、E、F、G七种元素,期中 A、B、C、D、E、F为短周期元素且原子序数依次增大;A的最高正价与最低负代数和为零;B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应;D的次外层电子数为最外层的三分之一;E原子半径在同周期中除稀有气体外最大,E与F可形成离子化合物EF,G的合金在生活中用量最大,用途最广。
(1)G在元素周期表中的位置是______________
(2)D、E、F离子半径由大到小顺序为:___________________(用离子符号表示)
(3)A与D形成原子个数比为1:1化合物的电子式为:_________________________
(4)D与E形成某离子化合物具有漂白性,该化合物和B与D形成的某化合物反应的化学方程式为:_______________________,试写出利用该反应原理在生活中的一个用途:_____________
(5)若X为正盐,加热该盐的化学方程式为:____________________________________
(6)用电子式表示EF的形成过程:______________________________________________
(7)B、C、F三种元素最高价氧化物的水化物的酸性由强到弱的顺序为:___________________
下列说法正确的一组是
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
③氯化钠水溶液在电流的作用下电离出Na+和Cl-,所以氯化钠是强电解质
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤熔融的电解质都能导电
⑥强电解质可能是离子化合物,也可能是共价化合物
| A.①③⑤⑥ | B.②④⑤⑥ |
| C.只有⑤ | D.只有⑥ |
A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
①D在周期表中的位置是____ ;
②用电子式表示A、B形成化合物的过程:____ ;
③D2C的电子式为 ;
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)C离子的结构示意图为 。D在周期表中位置 。
(2)写出E的电子式: 。
(3)A、D两元素形成的化合物属 (填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式: 。
(1)下列物质中:互为同素异形体的有 (填序号,下同),属于同位素的有 ,属于同一种物质的有 。
①液氯 ② Cl ③白磷 ④氯气 ⑤红磷 ⑥
Cl ③白磷 ④氯气 ⑤红磷 ⑥ Cl
Cl
(2)下列物质中:只存在共价键的是 (填序号,下同),只存在离子键的是 ,既存在离子键又存在极性共价键的是 ,既存在离子键又存在非极性共价键的是 。
①Ar ②CO2 ③Na2O2 ④KOH ⑤MgBr2 ⑥NH4Cl ⑦CaO ⑧H2SO4
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是
| A.离子半径的大小顺序为r(W2-)>r(Q-)>r(Y2-)>r(Z3+) |
| B.元素W的最高价氧化物对应水化物的酸性比Q的强 |
| C.元素X与Q的氢化物化合的产物中既含共价键又含离子键 |
| D.X、Z、W、Q四种元素的最高价氧化物对应的水化物均能与强碱反应 |
X、Y、Z、M和N均为短周期元素,X、Y、Z原子序数依次增大且最外层电子数之和为15,X与Z可形成XZ、XZ2型分子, Y与M气态化合物标准状况下密度约0.76g/L。N的原子半径为短周期元素中最大。回答下列问题:
(1)M、Z和N的元素符号分别为 、 、 。
(2)X、Y、Z、M四种元素的原子半径由大到小的顺序为 。
(3)由上述元素组成、既含有共价键又含有离子键的化合物,其中含有极性共价键或含有非极性共价键,各举一例用电子式表示为 、 。
(4)X和Y组成的离子XY-对环境有害,可在NaClO的碱性溶液中转化为碳酸盐和氮气,相应的离子方程式为 。
钾长石的主要成分为硅酸盐,由前20号元素中的四种组成,化学式为XYZ3W8,其中只有W显负价。X、Y的最外层电子数之和与Z的最高正价数相等,Y3+与W的阴离子具有相同的电子层结构,X、W的质子数之和等于Y、Z的质子数之和。下列说法错误的是
| A.离子半径:X>Y |
| B.氢化物的稳定性:W>Z |
| C.化合物X2W2和Y2W3中都不含共价键 |
| D.1 mol ZW2晶体所含Z-W键的数目为4NA(NA为阿伏加德罗常数的值) |