已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g)  2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是( )
A.反应②中的能量变化如图所示,则ΔH2=E1-E3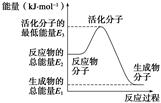 |
| B.H2的燃烧热为241.8 kJ·mol-1 |
| C.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2充分反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 |
| D.氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)ΔH=+906 kJ·mol-1 |
某科学家利用二氧化铈()在太阳能作用下将
、
转变成
、
。其过程如下:
+
+
+
+
+
下列说法不正确的是
| A. |
该过程中
|
| B. | 该过程实现了太阳能向化学能的转化 |
| C. |
右图中△
|
| D. |
以
|
(5分)能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
(1))氢气在燃烧时,放出大量热量,说明该反应是 热反应,这是由于反应物的总能量 生成物的总能量(填“大于”、“小于”或“等于”,下同);从化学反应的本质角度来看,由于断裂反应物中的化学键吸收的总能量 形成产物的化学键放出的总能量
(2)氢气被公认为是21世纪代替矿物燃料的理想能源,5.2g氢气燃烧时放出286kJ热量,而每千克汽油燃烧时放出的热量为46000kJ。试据此分析氢气作为能源代替汽油的优势
。
将盛有粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
| A. |
|
| B. | 该反应中,热能转化为产物内部的能量 |
| C. | 反应物的总能量高于生成物的总能量 |
| D. |
反应的热化学方程式为:
|
下列依据热化学方程式得出的结论正确的是(双选)( )。
| A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 |
| C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a;2C(s)+O2(g)===2CO(g) ΔH=b,则a>b |
| D.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
化学反应中既有物质变化,又有能量变化,释放或吸收热量是化学反应中能量变化的主要形式之一。已知C(石墨)、H2(g)燃烧的热化学方程式分别为:
① C(石墨)+ O2(g)=CO(g)
O2(g)=CO(g)  ="-111.0" KJ·mol-1
="-111.0" KJ·mol-1
② H2(g)+  O2(g) =H20(g)
O2(g) =H20(g)  ="-242.0" kJ·mol-1
="-242.0" kJ·mol-1
③ C(石墨)+O2(g)=CO2(g)  ="-394.0" kJ·mol-1
="-394.0" kJ·mol-1
请解答下列问题:
(1)化学反应中有能量变化的本质原因是反应过程中有 的断裂和形成。上述三个反应都是 (填“吸热”或“放热”)反应。
(2)在热化学方程式中,需要标明反应物及生成物的状态的原因是 ;在①中,02的化学计量数“1/2”是表示 (填字母)。
a.分子个数 b.物质的量 c.气体的体积
(3)反应2H20(g)=2H2(g)+02(g)的 = KJ·mol-1。
= KJ·mol-1。
(4)若C(金刚石)+02(g)=C02(g)的 ="-395.0" kJ·mol-1,则稳定性:金刚石 (填“>”、“<”或“=”)石墨。
="-395.0" kJ·mol-1,则稳定性:金刚石 (填“>”、“<”或“=”)石墨。
(5)已知形成H20(g)中的2 mol H-O键能放出926.0 kJ的能量,形成1 mol 02(g)中的共价键能放出498.0 kJ的能量,则断裂1 mol H2(g)中的H-H键需要的能量 KJ。
(6)工业制氢气的一个重要途径是用CO(g)与H2O(g)反应生成C02(g)和H2(g),则该反应的热化学方程式是 。
下列有关热化学方程式的叙述中,正确的是 ( )
| A.含20.0g NaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中[和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.8kJ/mol |
B.已知热化学方程式:SO2(g)+ O2(g) O2(g) SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ |
| C.已知2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol |
| D.已知①S(s)+O2(g)=SO2(g); △H1②S(g)十O2(g)=SO2(g);△H2 则△H1>△H2 |
下列说法正确的是( )
| A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)= 2CO(g)+O2(g)反应的△H=+(2×283.0)kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S和无毒的气体。已知:
①CO(g)+ O2(g)=CO2(g)
O2(g)=CO2(g)  H=-283.0 kJ·mol-1
H=-283.0 kJ·mol-1
②S(g)+ O2(g)=SO2(g)  H=-296.0 kJ·mol-1
H=-296.0 kJ·mol-1
下列说法正确的是
| A.CO的燃烧热为566.0 kJ·mol-1 |
B.反应② H<0,所以该反应能自发进行 H<0,所以该反应能自发进行 |
| C.使用催化剂能提高其转化率 |
| D.根据①和②推知总反应为2CO(g)+SO2(g)=S(s)+2CO2 (g) △H=-270kJ·mol-1 |
“神七”登天标志着我国的航天事业进入了新的篇章。
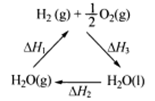
(1)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g) =2NO2(g) △H =" +67.7" kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H = -534.0 kJ·mol-1
NO2(g)  1/2N2O4(g) △H = -26.35 kJ·mol-1
1/2N2O4(g) △H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
_______________________________________________________________________。
(2)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
燃料电池放电时的负极反应为:___________________________________。
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标况),则该段时间内水电解系统中转移电子的物质的量为______________mol。
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH——4e— = O2↑+2H2O,则阴极反应为:____________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行?_______,理由是:___________________________________。
单斜硫和正交硫转化为二氧化硫的能量变化如图,下列说法正确的是
| A.S(s,单斜) = S(s,正交)△H = +0.33kJ·mol -1 |
| B.正交硫比单斜硫稳定 |
| C.相同物质的量的正交硫比单斜硫所含有的能量高 |
| D.①式表示断裂lmol O2中的共价键所吸收的能量比形成1mol SO2中的共价键所放出的能量少297.16kJ |
(最后一空2分,其余每空1分,共8分)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
 (1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由
是 ; (2)图中△H= KJ·mol-1;
(2)图中△H= KJ·mol-1; (3)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求
(3)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求
计算过程)。
下列依据热化学方程式得出的结论正确的是( )
| A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ·mol-1 则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 |
| C.已知C(石墨,s)=C(金刚石,s);△H>0,则石墨比金刚石稳定 |
| D.己知2C(s)+2O2(g)=2CO2(g));△H=a、2C(s)+O2(g)=2CO(g);△H=b,则a>b |
下列关于反应热的描述中正确的是
| A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热为 ΔH=2×(-57.3)kJ/mol |
| B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)===2CO(g)+O2(g)的ΔH=+566.0 kJ/mol |
| C.在101 kPa、25 ℃时,2 g H2完全燃烧生成液态水,放出285.8 kJ的热量,则表示氢气标准燃烧热的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ/mol |
| D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的标准燃烧热 |
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
| A.1/2N2H4(g)+1/2O2(g)=1/2N2(g)+H2O(g) ΔH=+267 kJ·mol-1 |
| B.N2H4(g)+O2(g)==N2(g)+2H2O(g) ΔH =-534 kJ·mol-1 |
| C.N2H4(g)+O2(g)==N2(g)+2H2O(g) ΔH =+534 kJ·mol-1 |
| D.N2H4(g)+O2(g)==N2(g)+2H2O(l) ΔH =-133.5 kJ·mol-1 |