(6分)(1)氨气催化氧化生产硝酸,硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)= 2H2O(g) ΔH="-483.6" kJ·mol-1
N2(g)+2O2(g)= 2NO2(g) ΔH="+67.7" kJ·mol-1
则H2还原NO2生成水蒸气反应的热化学方程式是 。
(2)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g) 2NH3(g) ΔH="-92" kJ·mol-1。请回答下列问题:
2NH3(g) ΔH="-92" kJ·mol-1。请回答下列问题:
①取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量 92 kJ(填“大于”“等于”或“小于”),原因是 ;
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据右侧能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g) △H < 0 ,其平衡常数K与温度T的关系如下表:
2NH3(g) △H < 0 ,其平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
①该反应的平衡常数表达式:K=
②试判断K1 K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g) 2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是 。
2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是 。
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)= ,以NH3表示该过程的反应速率v(NH3)= 。
(5) 实验室制取氨气的化学反应方程式 .
(18分)钛(Ti)被称为继铁、铝之后的第三金属,江西省攀枝花和西昌地区的钒钛磁铁矿储量十分丰富。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:
⑴电解食盐水时,总反应的离子方程式_____________________________________。
⑵写出钛铁矿经氯化法得到四氯化钛的化学方程式:___________________。
⑶已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH____________________
反应 在Ar气氛中进行的理由是____________________。
在Ar气氛中进行的理由是____________________。
⑷在上述产业链中,合成192 t甲醇理论上需额外补充H2__________t(不考虑生产过程中物质的任何损失)。
⑸以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是____________________________________________。
(6)已知2A2(g)+B2(g)  2C3(g);△H="-a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H="-a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
①比较a____________b(填>、=、<)
②此反应的平衡常数表达式为________________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)
③能说明该反应已经达到平衡状态的是______。
| A.v(C3)=2v(B2) | B.容器内压强保持不变 |
| C.v逆(A2)=2v正(B2) | D.容器内的密度保持不变 |
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题: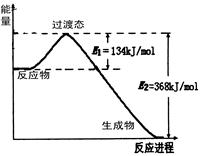
右图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c = 4.18J/(g·℃),溶液的密度都近似为1g/mL,中和热△H=____________________(填表达式,不用化简)若将H2SO4溶液换成相同物质的量浓度的CH3COOH溶液,测得的△H______填(“偏大”、“偏小”或“相同”)若将稀硫酸换成浓硫酸来做该实验,测得的△H___________(填“偏大”、“偏小”或“相同”)
按要求回答下列问题:
(1)金刚石、石墨燃烧的热化学方程式:
①C(s,金刚石)+O2(g) =CO2(g) △H = -395.4 kJ/mol
②C(s,石墨)+O2(g) =CO2(g) △H = -393.5 kJ/mol
则石墨转化为金刚石的反应热△H= 。
(2)试写出硫酸铜溶液中加入过量浓氨水的离子方程式: 。
(3)已知25℃时,CH3COOH的 Ka=1.8×10-5,H2CO3的Ka1=4.1×10-7 ,Ka2=5.6×10-11,
等物质的量浓度的下列溶液中,NH4+的浓度由大到小的顺序是 (填序号)。
①CH3COONH4 ②NH4HCO3 ③ NH4HSO4 ④ NH4NO3
分别取40mL的0.50 mol/L盐酸与40mL的0.55 mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1 mol 水时放出57.3 kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式__________________________________。
(2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其原因是_____________________________________________;
(3)假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃)。为了计算中和热,实验时还需测量的数据有(填序号)________。
| A.反应前盐酸溶液的温度 |
| B.反应前盐酸溶液的质量 |
| C.反应前氢氧化钠溶液的温度 |
| D.反应前氢氧化钠溶液的质量 |
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
| 实验 序号 |
起始温度t1/℃ |
终止温度t2/℃ |
|
| 盐酸 |
氢氧化钠 |
混合溶液 |
|
| 1 |
20.0 |
20.1 |
23.2 |
| 2 |
20.2 |
20.4 |
23.4 |
| 3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________;
(1)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.4 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为______________________________;
(2)在体积不变的密闭容器中进行(1)反应,达到平衡后(填“正向移动”、“逆向移动”、“增大”、“减小”或“不变”):
①扩大容器体积,平衡___________,c(H2)____________(与原平衡相比);
②升高温度,正反应速率________ ,逆反应速率___________;
体系的压强__________,平衡___________,平衡常数_____________;
③加入催化剂,H2的物质的量___________________。
“西气东输”是西部开发的重点工程,这里的气体是指天然气,其主要成分是甲烷。工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2,两者的体积比约为1:1。已知1mol CO气体完全燃烧生成CO2气体放出283kJ热量,1molH2完全燃烧生成液态水放出286kJ热量;1molCH4气体完全燃烧生成CO2气体和液态水放出890kJ热量。
(1)写出H2完全燃烧生成液态水的热化学反应方程式:_________________________,若1molCH4气体完全燃烧生成CO2气体和水蒸气,放出的热量________890kJ(填“>”、“=”或“<”)
(2)忽略水煤气中其它成分,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为________;燃烧生成的CO2的质量比约为________________。
(3)以上数据和计算说明,以天然气代替水煤气作民用燃料,突出的优点是________________。
(11分)已知短周期元素X、W、Z、Y核电荷数依次增大。X为原子半径最小的元素,W的最外层电子数是次外层的二倍,Y的最外层电子数为电子层数的三倍。
(1)写出Z单质的电子式_______________________
(2)由X、W、Z三种元素可组成火箭燃料甲,三种元素质量比为2∶6∶7,甲蒸气密度是同温同压下氢气密度的30倍,甲分子式________。Z、Y可形成多种化合物,其中化合物乙Z2Y4可做为火箭燃料燃烧时的供氧剂。虽然化合物甲与乙都有毒,但燃烧产物却无毒。写出化合物甲与乙反应的化学方程式: ________________________
该反应生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和。
(3)X、Y两种元素的单质已被应用于字宙飞船的燃料电池中,如图所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电极表面放电。
①b是电池的_____________极,a电极上的电极反应式是_________________________,消耗n molY单质时电池内转移的电子个数约为_______________。
②如果燃料电池中,a电极上改为通入X与W两种元素形成 的化合物丙(其它条件不变)写出b电极上的电极反应式是_________________________________。
③如果只把燃料电池电解质改为掺入了三氧化二釔的ZrO2晶体,它在高温下传导O2-(其它条件不变),电池工作时,固体电解质里的O2-向____________极(填a或b)移动,正极反应式为________________________。
直接排放煤燃烧产生的烟气会引起严重的环境问题,将烟气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,最终生成硫酸钙。硫酸钙可在下图所示的循环燃烧装置的燃料反应器中与甲烷反应,气体产物分离出水后得到几乎不含杂质的二氧化碳,从而有利于二氧化碳的回收利用,达到减少碳排放的目的。

请回答下列问题:
(1)煤燃烧产生的烟气直接排放到空气中,引发的主要环境问题有。(填写字母编号)
| A. | 温室效应 | B. | 酸雨 | C. | 粉尘污染 | D. | 水体富营养化 |
(2)在烟气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间二氧化碳以增加其脱硫效率;脱硫时控制浆液的值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
①二氧化碳与石灰石浆液反应得到的产物为。
②亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为。
(3)已知1mol 在燃料反应器中完全反应生成气态水时吸收 160.1
,1
在氧气中完全燃烧生成气态水时放热802.3
。写出空气反应器中发生的热化学方程式:。
(4)回收的与苯酚钠在一定条件反应生成有机物M,其化学式为
,
经稀硫酸酸化后得到一种药物中间体
,N的结构简式为
 。
。
①M的结构简式为。
②分子中无,醛基与苯环直接相连的N的同分异构体共有种。
(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1 >E2,则该反应为 (填“吸热”或“放热”)反应。
②已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=Q1kJ·mol-1
2CO2(g)+H2 (g)=C2H2(g)+2O2(g) △H2=Q2kJ·mol-1。根据盖斯定律,计算此时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变为 kJ·mol-1(用含有Q1和Q2的式子表示)。
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。在反应体系中加入催化剂,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”),对反应热是否有影响?_______________,原因是_________ 。
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。根据图二回答下列问题:
① P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式 。
② P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2______△H1(填“大于”、“小于”或“等于”),原因是 。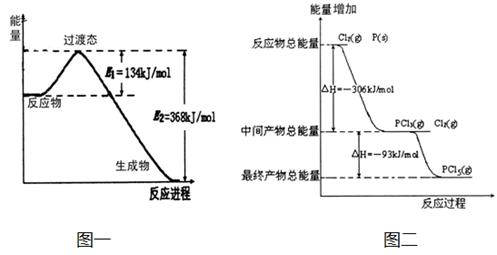
指出下列反应属于吸热反应还是放热反应。
①燃烧木炭取暖 ; ②煅烧石灰石制生石灰 ;
③Ba(OH)2·8H2O晶体与氯化铵晶体反应 ; ④铝与稀盐酸反应 ;
⑤食物因氧化而腐败 ; ⑥生石灰与水作用制熟石灰 ;
⑦灼热的炭与二氧化碳反应 ; ⑧酸碱中和反应 。
(6分)按要求回答下列问题:
(1)实验测得,5g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式
(2)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应生成正盐时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的热化学方程式
_____________ 。
(3)已知下列反应的焓变:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) △H2=-393.5kJ/mol
③2 H2(g)+O2(g) =2H2O(l) △H3=-285.8kJ/mol
试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH=