[四川]2012年普通高等学校招生全国统一考试理综化学部分
下列关于"化学与健康"的说法不正确的是
| A. | 服用铬含量超标的药用胶囊会对人体健康造成危害 |
| B. | 食用一定量的油脂能促进人体对某些维生素的吸收 |
| C. | "血液透析"利用了胶体的性质 |
| D. | 光化学烟雾不会引起呼吸道疾病 |
设为阿伏加德罗常数的值,下列叙述正确的是
| A. | 标准状况下,33.6 氟化氢中含有氟原子的数目为1.5 |
| B. | 常温常压下,7.0 乙烯与丙烯的混合物中含有氢原子的数目为 |
| C. | 50 18.4 浓硫酸与足量铜微热反应,生成SO 2分子数目为0.46 |
| D. | 某密闭容器盛有0.1 和0.3 ,在一定条件下充分反应,转移电子的数目为0.6 |
已知、、、为短周期元素,、同主族,、、同周期,的气态氢化物的稳定性大于Z的气态氢化物稳定性,、为金属元素,的阳离子的氧化性小于的阳离子的氧化性,下列说法正确的是
| A. | 、 、 、 的原子半径依次减小 |
| B. | 与 形成的化合物中只含离子键 |
| C. | 的气态氢化物的沸点一定高于 的气态氢化物的沸点 |
| D. | 若 与 的原子序数相差5,则二者形成化合物的化学式一定为 |
下列离子方程式正确的是
| A. | 钠与水反应: ↑ |
| B. | 硅酸钠溶液与醋酸溶液混合: ↓ |
| C. |
0.01
溶液与0.02
溶液等体积混合:
↓ ↓ |
| D. | 浓硝酸中加入过量铁粉并加热: ↑ |
常温下,下列溶液中的微粒浓度关系正确的是
新制氯水中加入固体.=++
=8.3的溶液:>>>
=11的氨水与=3的盐酸等体积混合:=>=
0.2溶液与0.1溶液等体积混合:
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:。下列有关说法正确的是()
| A. | 检测时,电解质溶液中的 向负极移动 |
| B. | 若有0.4 电子转移,则在标准状况下消耗4.48 氧气 |
| C. | 电池反应的化学方程式为: |
| D. | 正极上发生的反应为: |
在体积恒定的密闭容器中,一定量的与1.100在催化剂作用下加热到600℃发生反应: ,。当气体的物质的量减少0.315时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是
| A. | 当 的生成速率与 的消耗速率相等时反应达到平衡 |
| B. | 降低温度,正反应速率减小程度比逆反应速率减小程度大 |
| C. | 将平衡混合气体通入过量 溶液中,得到沉淀的质量为161.980 |
| D. | 达到平衡时, 的转化率为90% |
向27.2和的混合物中加入某浓度的稀硝酸0.5,固体物质完全反应,生成和,在所得溶液中加入1.0的溶液1.0,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2。下列有关说法不正确的是()
| A. | 与 的物质的量之比为2∶1 | B. | 硝酸的物质的量浓度为2.6 |
| C. | 产生的NO在标准状况下的体积为4.48 | D. | 、 与硝酸反应后剩余 为0.2 |
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。已知为气态单质,是地壳中含量最多的金属元素的单质,为氧化物,为黑色固体,为红棕色气体,为红褐色沉淀。

请回答下列问题:
(1)中所含元素位于周期表中第周期族。
(2)在中燃烧的现象是。
(3)的反应中,被氧化与被还原的物质的量之比是。
(4)的离子方程式是。
(5)受热分解的化学方程式是。
已知:,代表原子或原子团。是一种有机合成中间体,结构简式为:,其合成发生如下:

其中,、、、分别代表一种有机物,合成过程中的其他产物和反应条件已略去。与在一定条件下反应可以生成酯,的相对分子质量为168。
请回答下列问题:
(1)能发生反应的类型有
(2)已知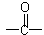 为平面结构,则分子中最多有
为平面结构,则分子中最多有
(3)写出与在一定条件下反应生成的化学方程式
(4)写出含有3个碳原子且不含甲基的的同系物的结构简式:
(5)写出第②步反应的化学方程式
甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:

实验中,先用制的的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。

甲小组测得,反应前氧化铜的质量、氧化铜反应后剩余固体的质量、生成氮气在标准状况下的体积。
乙小组测得,洗气前装置D的质量、洗气后装置D的质量、生成氨气在标准状况下的体积。
请回答下列问题:
(1)写出仪器a的名称。
(2)检查A装置气密性的操作是。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中。
| 实验装置 |
实验药品 |
制备原理 |
|
| 甲小组 |
A |
氢氧化钙、硫酸、硫酸铵 |
反应的化学方程式为。 |
| 乙小组 |
浓氨水、氢氧化钠 |
用化学平衡原理分析氢氧化钠的作用: 。 |
(4)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为。
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是
。为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氨气的体积,得出了合理的实验结果。该药品的名称是。
直接排放煤燃烧产生的烟气会引起严重的环境问题,将烟气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,最终生成硫酸钙。硫酸钙可在下图所示的循环燃烧装置的燃料反应器中与甲烷反应,气体产物分离出水后得到几乎不含杂质的二氧化碳,从而有利于二氧化碳的回收利用,达到减少碳排放的目的。

请回答下列问题:
(1)煤燃烧产生的烟气直接排放到空气中,引发的主要环境问题有。(填写字母编号)
| A. | 温室效应 | B. | 酸雨 | C. | 粉尘污染 | D. | 水体富营养化 |
(2)在烟气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间二氧化碳以增加其脱硫效率;脱硫时控制浆液的值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
①二氧化碳与石灰石浆液反应得到的产物为。
②亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为。
(3)已知1mol 在燃料反应器中完全反应生成气态水时吸收 160.1,1 在氧气中完全燃烧生成气态水时放热802.3。写出空气反应器中发生的热化学方程式:。
(4)回收的与苯酚钠在一定条件反应生成有机物M,其化学式为,经稀硫酸酸化后得到一种药物中间体,N的结构简式为 。
。
①M的结构简式为。
②分子中无,醛基与苯环直接相连的N的同分异构体共有种。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号