甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ/mol;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol。
(1)甲醇蒸气完全燃烧的热化学反应方程式为__________________________。
(2)反应②中的能量变化如图所示,则ΔH2=________ kJ/mol(用E1、E2表示)。
(3)H2(g)的燃烧热为________。
(4)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点:______(写出两点即可)。
能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
① 2H2(g)+O2(g)=2H2O(l)  H=-570kJ/mol ;② H2(g)+1/2O2(g)=H2O(g)
H=-570kJ/mol ;② H2(g)+1/2O2(g)=H2O(g)  H="-242kJ/mol"
H="-242kJ/mol"
③ C(s)+1/2O2(g)="CO" (g)  H=" —110.5kJ/moL" ④ C(s)+O2(g)=CO2(g)
H=" —110.5kJ/moL" ④ C(s)+O2(g)=CO2(g)  H="-393.5kJ/moL"
H="-393.5kJ/moL"
⑤ CO2(g) +2H2O(g)=2CH4(g) +2 O2(g)  H=" +890kJ/moL"
H=" +890kJ/moL"
回答下列问题:
(1)上述反应中属于吸热反应的有(填写序号) 。
(2)H2的燃烧热为 。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。 已知C(s) + H2O(g) = H2(g)+ CO (g)  H=akJ/moL;
H=akJ/moL;
则a= ; 又已知自由能 G=
G= H—T
H—T S,当
S,当 G<0时可自发进行。则该反应在什么条件下可自发进行 。
G<0时可自发进行。则该反应在什么条件下可自发进行 。
在一定条件下A与B反应可生成C和D,其能量变化如图:
(1)下列有关反应A+B = C+D的说法正确的是 。
| A.反应前后原子的种类和数目一定不变 |
| B.该反应若有能量变化,则一定是氧化还原反应 |
| C.该反应若为放热反应,则不需加热反应就一定能自发进行 |
| D.反应物的总质量与生成物的总质量一定相等,且遵循能量守恒 |
(2)若E1<E2,则生成物的总能量 (填“>”、“<”或“=”)反应物的总能量,该反应为 (填“吸热”或“放热”)反应。
(每空2分,共6分)热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。
(1)如下图Ⅰ所示表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:________________________。
(2)图Ⅱ表示氧族元素中的氧、硫、硒、碲在生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准态下,发生分解反应的热化学方程式:_________________________________________________。
(3)已知:
①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g);
ΔH=-25 kJ·mol-1,
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);
ΔH=-47 kJ·mol-1,
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);
ΔH=19 kJ·mol-1
请写出CO还原FeO的热化学方程式:
________________________________________________________________________。
(11分)A、B、C、D是四种短周期元素,它们的原子序数依次增大。其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示:
常温下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质和丁物质为固体且都为离子化合物。请填写下列空白:
(1)丙物质的电子式为 ,丁物质中阴离子与阳离子的个数之比为 。
(2)若标准状况下5.6L甲物质完全燃烧放出的热量为QKJ,试写出表示甲物质燃烧热的热化学方程式 。
(3)B、C两种元素按原子个数比为1:2可形成化合物戊,A、C、D三种元素按原子个数比为1:1:1可形成化合物己,则己与戊按物质的量之比为3:2完全反应后的溶液中各离子浓度的大小关系为 。
(4)某同学设计了一个以结构简式是BA3-CA物质为燃料的电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如下图:
①写出ⅰ中通入该物质这一极的电极反应式 。
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ;在t2时所得溶液的pH约为 。
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ·mol-1。请回答下列问题:

(1)图中A、C分别表示 、 ,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”),理由是
(2)图中△H= KJ·mol-1
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器编号 |
起始时各物质物质的量/mol |
达到平衡的时间/min |
达平衡时体系能量的变化/kJ |
||||
| CO |
H2O |
CO2 |
H2 |
||||
| ① |
1 |
4 |
0 |
0 |
t1 |
放出热量:32.8 kJ |
|
| ② |
2 |
8 |
0 |
0 |
t2 |
放出热量:Q |
|
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量 (填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为 %。
(3)下列叙述正确的是 (填字母序号)。
A、平衡时,两容器中H2的体积分数相等
B、容器②中反应达平衡状态时,Q > 65.6 kJ
C、反应开始时,两容器中反应的化学反应速率相等
D、容器①中,化学反应速率为:
(4)已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式: 。
(5)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 ml 、5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(DH),化学反应的DH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
| 键能/kJ·mol−1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1) 比较下列两组物质的熔点高低(填“>”或“<”)
SiC Si; SiCl4 SiO2
(2) 右图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的 顶点用“●”表示出与之紧邻的硅原子。
(3) 工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),该反应的反应热DH=
Si(s)+4HCl(g),该反应的反应热DH=
kJ/mol
“天宫一号”于2011年9月在酒泉卫星发射中心发射,标志着我国的航空航天技术迈进了一大步。火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。
(1)用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)=N2O4(g) △H=+10.7kJ· mol-1
N2H4(g)+02(g)=N2(g)+2H20(g) △H="-543" kJ· mol-1
写出气态肼和N2O4反应的热化学方程式为: ;
(2)已知四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮。试推断由二氧化氮制取四氧化二氮的反应条件(或措施): 。
2SO2(g)+ O2(g) 2SO3(g) △H =- a kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
2SO3(g) △H =- a kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
⑴图中A点表示__________________,a=__________。
⑵Ea的大小对该反应的△H _______(填“有”或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点_________(填“升高”、“降低”或“不变”)。
⑶已知单质硫的燃烧热为296kJ·mol-1,写出反应的热化学方程式:_____________________,常温常压下,由单质硫和氧气经两步反应,生成3 mol SO3(g),放出的总热量为___ _。
(1)2SO2(g)+O2(g)  2SO3(g) 反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99kJ/mol。请回答下列问题:
2SO3(g) 反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99kJ/mol。请回答下列问题: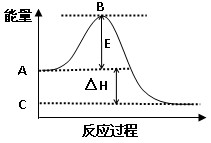
①图中A点表示 ; C点表示 ;E的大小对该反应的反应热 ;(填“有”或“无”)影响。
②图中△H= kJ/mol。
(2)25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,则氢气的燃烧热的化学方程式为 。
(3)①C(s) + O2(g) = CO2(g);ΔH = –393.5kJ/mol
②CO(g) + 1/2 O2(g) = CO2(g);ΔH = –283kJ/mol
根据上述信息,写出C转化为CO的热化学方程式为 。
.化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化。
(1)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N的键能为________kJ·mol-1,由上图写出N2(g)和O2(g)生成NO(g)的热化学反应方程式________。
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①根据下列反应的热化学反应式,计算由C(石墨)和H2(g)反应生成1molC2H2(g)的ΔH。
C(石墨)+O2(g)===CO2(g)ΔH1=-393.5kJ·mol-1
2H2(g)+O2(g)===2H2O(l)ΔH2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH3=-2599.2kJ·mol-1,
则由C(石墨)和H2(g)反应生成1molC2H2(g)的ΔH=________kJ·mol-1。
②已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,并放出XkJ热量。已知单质碳的燃烧热为YkJ·mol-1,则1molC与O2反应生成CO的反应热ΔH为________。
(8分)已知化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化:
(1)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N键的键能为 kJ·mol-1。根据上图写出N2(g)和O2(g)生成NO(g)的热化学方程式: 。
(2)NO(g)分解生成N2(g)和O2(g)的热化学方程式为: 。
当有16 g O2(g)生成时,该反应中放出的热量为: kJ。
现有下列物质:
①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡
⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的电解质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
(4)在水溶液中,不能完全电离的是 ;
2008年北京奥运会所用火炬燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷(C3H8),已知常温下1mol丙烷燃烧放出2220kJ热量,1mol正丁烷燃烧放出2878kJ热量,1mol异丁烷燃烧放出2869.6kJ热量。试回答下列问题:
(1)表示正丁烷燃烧的热化学反应方程式 ;
(2)下列有关说法正确的是 ;
| A.奥运火炬燃烧时的能量转化主要是由化学能转变为热能 |
| B.相同条件下相同质量的正丁烷和丙烷充分燃烧,放出的热量正丁烷的比较多 |
| C.正丁烷比异丁烷不稳定 |
| D.异丁烷分子中的碳氢键比正丁烷的多 |
(3)已知1mol H2燃烧生成液态水放出热量是285.8 kJ,现有5mol 氢气和丙烷的混合气体,完全燃烧时放热3847kJ,则氢气和丙烷的体积比为 。