[陕西]2011-2012学年陕西宝鸡金台区高二上学期期中质量检测化学试卷
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源的是
①天然气 ②太阳能 ③风能 ④石油 ⑤煤 ⑥生物质能 ⑦核能 ⑧氢能
| A.①②③④ | B.②③⑥⑧ | C.①②⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
下图为某反应的焓变示意图,下列有关该反应的说法中正确的是
| A.△H>0 | B.X能量一定高于M |
| C.该反应一定不必加热就可以发生 | D.该反应为放热反应 |
在一定温度下,体积不变的密闭容器中可逆反应A(g)+3B(g)  2C(g) 达到平衡的标志是
2C(g) 达到平衡的标志是
A.气体的密度不再变化
B.A、B、C的浓度之比为1:3:2
C.A、B、C的浓度不再变化
D.单位时间内生成n molA,同时生成3n molB
在中和热测定的实验中不需要用到的仪器是:
| A.天平 | B.温度计 | C.环形玻璃搅拌棒 | D.量筒 |
下列热化学方程式书写正确的是
A.2SO2+O2 2SO3;△H= —196.6 kJ/mol 2SO3;△H= —196.6 kJ/mol |
| B.C(s)+O2(g) = CO2(g);△H=393.5 kJ/mol |
| C.H+(aq)+OH-(aq) = H2O(l);△H= 57.3 Kj |
| D.1/2H2(g)+1/2Cl2(g) = HCl(g);△H= —92.5 kJ/mol |
中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是
| A.用反应物、产物中键能数据可判断对应反应的反应热 |
| B.用沸点数据推测将一些液体混合物用分镏的方法分离开来的可能性 |
| C.用反应热数据的大小判断不同反应的反应速率的快慢 |
| D.用平衡时各组分的物质的量浓度可计算一定温度下反应的平衡常数 |
下列说法或表示方法正确的是
| A.由石墨比金刚石稳定可知:C(金刚石, s) = C(石墨, s) ΔH﹤0 |
| B.强酸跟强碱反应放出的热量就是中和热 |
| C.反应物的总能量低于生成物的总能量时,该反应一定不能发生 |
| D.在101KPa、25℃时,1gH2完全燃烧生成气态水,放出120.9kJ热量,则氢气的燃烧热为241.8 kJ/mol |
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硝酸;③稀醋酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是
| A.△H1>△H2>△H3 | B.△H1<△H2<△H3 |
| C.△H1>△H2=△H3 | D.△H1=△H2<△H3 |
在恒温、体积为2L的密闭容器中进行反应:2A(g)  3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速率为
3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速率为
A.v(B)=0.03mol/(L·s)
B.v(B)="0.045mol/(L·s)"
C.v(C)=0.03mol/(L·s)
D.v(C)="0.06mol/(L·s)"
反应C(s)+H2O(g)  CO(g)+H2(g),在密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g),在密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
| A.保持体积不变,加入CO气体 | B.将C(s)粉碎成细小粉末 |
| C.保持体积不变,充入氩气 | D.降低反应体系温度 |
下列事实中,不能用勒夏特列原理解释的是
| A.Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| B.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 |
| C.实验室常用排饱和食盐水的方法收集氯气 |
| D.棕红色NO2加压后颜色先变深后变浅 |
合成氨所需的氢气可由水煤气反应制得,其中的一步反应为: CO(g)+H2O(g) 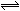 CO2(g) +H2(g);△H=-43kJ·mol-1对于此反应,下列措施中能提高CO转化率的是
CO2(g) +H2(g);△H=-43kJ·mol-1对于此反应,下列措施中能提高CO转化率的是
| A.增大压强 | B.升高温度 | C.增大CO的浓度 | D.增大水蒸气的浓度 |
对于可逆反应2SO2 (g)+ O2(g) 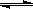 2SO3(g) DH <0在一定温度下其平衡数为K,下列说法正确的是
2SO3(g) DH <0在一定温度下其平衡数为K,下列说法正确的是
| A.增大SO2的转化率K值一定增大 | B.减小压强K值减小 |
| C.升高温度K值增大 | D.K值越大SO2转化率越大 |
已知,H2(g) +I2(g)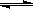 2 HI(g)DH <0有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2 HI(g)DH <0有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
| A.甲降低温度,乙不变 | B.甲中加入0.1molHe,乙不改变 |
| C.甲、乙提高相同温度 | D.甲增加0.1mol H2,乙增加0.1mol I2 |
在下面的自发过程中,你认为其中能用熵判据解释的是
| A.水由高处流向低处 | B.2H2(g)+O2(g)=2H2O(l) ΔH=-483.6 kJ/mol |
| C.墨水滴在水中会扩散到整个水体 | D.-10℃的液态水自动结冰成为固态 |
某温度下,密闭容器中发生反应 a X (g) 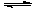 b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
| A.可逆反应的化学计量数:a>b+c | B.压缩容器的容积时,υ正增大,υ逆减小 |
| C.达到新平衡时,物质X的转化率减小 | D.达到新平衡时,混合物中Z的质量分数增大 |
向容积为2 L的密闭容器中充入2 mol A气体和1 mol B气体,在一定条件下发生如下列反应:2A(g)+B(g) 3C(g);经2 s后达到平衡,测得C气体的浓度
3C(g);经2 s后达到平衡,测得C气体的浓度
为0.6 mol·L-1。下列说法中正确的是
① 用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
② 用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③ 平衡时物质A与B的转化率相等
④ 平衡时物质B的浓度为0.2 mol·L-1
| A.①②③ | B.①③ | C.②④ | D.①③④ |
(1)2SO2(g)+O2(g)  2SO3(g) 反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99kJ/mol。请回答下列问题:
2SO3(g) 反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99kJ/mol。请回答下列问题: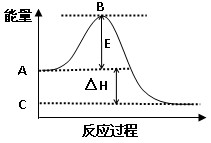
①图中A点表示 ; C点表示 ;E的大小对该反应的反应热 ;(填“有”或“无”)影响。
②图中△H= kJ/mol。
(2)25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,则氢气的燃烧热的化学方程式为 。
(3)①C(s) + O2(g) = CO2(g);ΔH = –393.5kJ/mol
②CO(g) + 1/2 O2(g) = CO2(g);ΔH = –283kJ/mol
根据上述信息,写出C转化为CO的热化学方程式为 。
在密闭容器中进行可逆反应 CO(g)+NO2(g) CO2(g)+NO(g),(正反应放热),
CO2(g)+NO(g),(正反应放热),
达到平衡后,只改变其中一个条件,对平衡的影响是:
(1)增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
(2)通人CO2气体,平衡 移动。
(3)加入催化剂,平衡 移动。
煤化工中常需研究不同温度下的平衡常数、投料比及产率等问题。已知:
CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数随温度的变化如下表:
CO2(g)+H2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
830 |
1000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题:(1)上述反应的正反应是 反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率
(填“增大”、“减小”或“不变”),容器内混合气体的压强 (填“增大”、“减小”或“不变”)。
(3)830℃,在恒容反应器中发生如表中的反应,按表中的物质的量投入反应混合物,其中向正反应方向进行的有 (选填A、B、C、D)。
(4)830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是 。
“碘钟”实验中,3I-+S2O82-=I3-+2SO42- 的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃时进行实验,得到的数据如下表: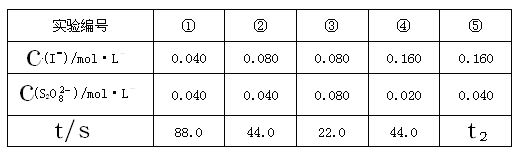
回答下列问题:
(1)该实验的目的是为了探究 因素对化学反应速率的影响。
(2)显色时间t2= 。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)
| A.<22.0s | B.22.0~44.0s | C.>44.0s | D.数据不足,无法判断 |
(4)通过分析比较上表数据,得到的结论是 。
在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
| 物 质 |
A |
B |
C |
| 初始浓度/mol·L-1 |
1.0 |
2.0 |
0 |
| 2min时,平衡浓度/mol·L-1 |
0.4 |
0.2 |
1.2 |
请填写下列空白:
(1)该反应方程式可表示为 ;反应达平衡时,A的转化率为 。
(2)从反应开始到达化学平衡,反应物A的平均反应速率为 ;25℃时,反应的化学平衡常数K值为_____________。
(3)若已知该反应为放热反应,下图表示由于条件改变而引起反应速度和化学平衡的变化情况:a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 。
(4)如果上述反应起始是按“1molA+3molB”充入,达平衡时C的浓度为a mol/L;维持容器体积和温度不变,按下列方法改变起始物质的量,达到平衡时C的浓度仍为a mol/L的是 (填序号):
①2 mol A+6 mol B ②2mol C ③4mol C ④0.5 mol A+1.5mol B+1 mol C
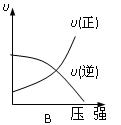
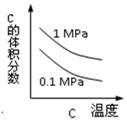
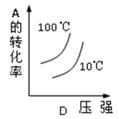
 2C(g) △H<0,下列各图中正确的是
2C(g) △H<0,下列各图中正确的是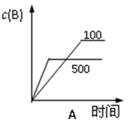
 粤公网安备 44130202000953号
粤公网安备 44130202000953号