已知:,下列说法正确的是()
| A. |
2
|
| B. |
1
|
| C. |
在相同条件下,1
|
| D. |
1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270
|
已知: ΔΗ=234.1kJ·mol-1
ΔΗ=-393.5 kJ·mol-1
则 的ΔΗ是()
| A. | -824.4 kJ·mol -1 | B. | -627.6 kJ·mol -1 |
| C. | -744.7 kJ·mol -1 | D. | -169.4 kJ·mol -1 |
右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是
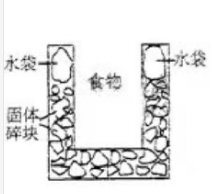
| A. | 硝酸铵 | B. | 生石灰 |
| C. | 氯化镁 | D. | 食盐 |
下列叙述不正确的是()
| A. | 铁表面镀锌,铁作阳极 |
| B. | 船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| C. |
钢铁吸氧腐蚀的正极反应:
|
| D. |
工业上电解饱和和食盐水的阳极反应:
|
25 ℃,101 时,强酸与强碱的稀溶液发生中和反应的中和热为57.3
,辛烷的燃烧热为5518
。下列热化学方程式书写正确的是()

| A. |
|
B. |
|
C. |
|
| D. |
|
E. |
|
F. |
|
| G. |
|
H. |
|
I. |
|
| J. |
|
K. |
|
L. |
|
下列热化学方程式数学正确的是(的绝对值均正确)
| A. |
|
| B. |
|
| C. |
|
| D. |
|
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
关于该电池的叙述正确的是:
| A.该电池能够在高温下工作 |
| B.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+ |
| C.放电过程中,H+从正极区向负极区迁移 |
| D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下 |
CO2 22.4/6 L
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
①每消耗1molCH4可以向外电路提供8mole-
②负极上CH4失去电子,电极反应式CH4+10OH--8e-=CO32-+7H2O
③负极上是O2获得电子,电极反应式为O2+2H2O+4e-=4OH-
④电池放电后,溶液PH不断升高
| A.①② | B.①③ | C.①④ | D.③④ |
下列热化学方程式中,正确的是
| A.甲烷的燃烧热ΔH=" -890.3" kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=" -890.3" kJ·mol-1 |
B.一定条件下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) ΔH =" -38.6" kJ·mol-1 2NH3(g) ΔH =" -38.6" kJ·mol-1 |
| C.在101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) ΔH=" -571.6" kJ·mol-1 |
| D.HCl和NaOH反应的中和热ΔH=" -57.3" kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1 |