已知:
根据以上热化学方程式判断,下列说法正确的是( )

| A. |
|
| B. |
上图可表示由
|
| C. |
|
| D. |
|
火箭推进器常以联氨(N2H4) 为燃料、过氧化氢为助燃剂。已知下列各物质反应的热化学方程式:
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH1=-533.23 kJ·mol-1
H2O(g)=H2O (l) DH2=–44 kJ·mol-1
2H2O2(l)=2H2O(l)+ O2(g) DH3=–196.4 kJ·mol-1
则联氨与过氧化氢反应的热化学方程式可表示为
| A.N2H4(g)+2H2O2(l)= N2(g)+4H2O(l)ΔH=+817.63 kJ·mol-1 |
| B.N2H4(g)+2H2O2(l)= N2(g)+4H2O(g)ΔH=-641.63 kJ·mol-1 |
| C.N2H4(g)+2H2O2(l)= N2(g)+4H2O(l)ΔH=-641.63 kJ·mol-1 |
| D.N2H4(g)+2H2O2(l)= N2(g)+4H2O(g)ΔH=-817.63 kJ·mol-1 |
下列说法或表示方法正确的是
| A.等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多 |
| B.由C(石墨)= C(金刚石) △H=+1.90 kJ/mol可知,金刚石比石墨稳定 |
| C.在101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为: 2H2(g)+O2(g)=2H2O(l) △H=-285.8kJ/mol |
| D.在稀溶液中,H+(aq)+ OH-(aq)=H2O(l) △H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ |
已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g)====CO2(g) △H= -393.51kJ•mol-1
C(金刚石)+O2(g)====CO2(g) △H= -395.41kJ•mol-1
据此判断,下列说法正确的是 ( )
| A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石低 |
| B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石高 |
| C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石低 |
| D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石高 |
在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
| A.CH3OH(l)+O2(g)===CO2(g)+2H2O(l)ΔH=+725.8 kJ/mol |
| B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=-1 452 kJ/mol |
| C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=-725.8 kJ/mol |
| D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=+1 452 kJ•mol‾1 |
已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:


则以下说法正确的是( )
| A.在该条件下金刚石比石墨稳定,等质量时金刚石的能量大于石墨 |
| B.金刚石转化为石墨为放热反应 |
| C.石墨转化为金刚石为物理变化 |
| D.由于石墨转化为金刚石为吸热反应,因此石墨在任何条件下都不可能转化为金刚石 |
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+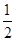 O2(g) ΔH=-226 kJ/mol
O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法错误的是
| A.CO的燃烧热为283 kJ/mol |
B.下图可表示由CO生成CO2的反应过程和能量关系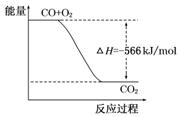 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023 |
Zn还原SiCl4的反应如下:
SiCl4(g) + 2Zn(l)  Si(s) + 2ZnCl2(g) ΔH1
Si(s) + 2ZnCl2(g) ΔH1
SiCl4(g) + 2Zn(g)  Si(s) + 2ZnCl2(g) ΔH2
Si(s) + 2ZnCl2(g) ΔH2
下列说法正确的是
| A.Zn(l)=Zn(g) ΔH =1/2(ΔH1-ΔH2) |
| B.用硅制作的太阳能电池是将化学能转化为电能 |
| C.增加Zn(g)的量,ΔH2变大 |
| D.以Zn片、铜片和稀硫酸构成的原电池,Zn片表面有气泡产生。 |
下图是N2与H2反应生成NH3的过程中能量变化的曲线图:下列叙述正确的是( )。
| A.该反应的热化学方程式为 N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热减小 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
下列与化学反应能量变化相关的叙述正确的是 ( )。
| A.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| B.1 mol S完全燃烧放热297.3 kJ,其热化学方程式:S+O2=SO2 ΔH=-297.3 kJ·mol-1 |
| C.1 mol H2SO4与1 mol Ba(OH)2反应生成1 mol BaSO4沉淀时放出的热量叫做中和热 |
| D.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
下列关于反应过程中能量变化的说法正确的是( )
A.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1
B.图中A、B曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH>0未使用和使用催化剂时,反应过程中的能量变化
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D.己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2
X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合物RY3、XW4,已知Y、R同主族,Z、R、W同周期。下列说法不正确的是( )
| A.原子半径:Z>R>W |
| B.X2W6分子中各原子均满足8电子结构 |
| C.气态氢化物的稳定性:HmW>HnR |
| D.Y、Z形成的化合物中只可能存在离子键 |
已知某化学反应A2(g)+2B2(g)=2AB2(g)(AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是:
A.该反应的进行一定需要加热
B.该反应的ΔH=-(E1-E2)kJ·mol-1
C.该反应中反应物的键能总和大于生成物的键能总和
D.断裂1molA-A键和2molB-B键放出E1kJ能量
氯气、溴蒸气分别与氢气反应的热化学方程式如下:
H2(g)+Cl2(g)=2HCl(g),生成2 mol HCl放热Q1 kJ
H2(g)+Br2(g)=2HBr(g),生成2 mol HBr放热Q2 kJ
已知Q1>Q2>0。下列说法正确的是
| A.上述两个反应中反应物的总能量均大于生成物的总能量 |
| B.上述两个反应中反应物的总能量均小于生成物的总能量 |
| C.H2(g)和Cl2(g)反应生成1 mol HCl(g)时放出Q1kJ的热量 |
| D.1 mol HBr(g)具有的能量大于1mol HBr(l)具有的能量 |