下列说法或表示方法中正确的是( )
| A.吸热反应中,新化学键形成吸收能量;放热反应中,新化学键形成放出能量 |
| B.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多 |
| C.相同体积浓度均为0.1 mol/L 盐酸和醋酸溶液分别与足量的NaOH稀溶液反应,前者放出热量多 |
| D.氢气的燃烧热为285.8 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ/mol |
下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是( )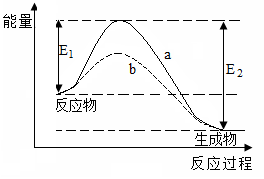
| A.该反应为吸热反应 |
| B.a与b相比,a的反应速率更快 |
| C.a与b相比,反应的平衡常数一定不同 |
| D.反应物吸收的总能量小于生成物释放的总能量 |
如图所示是101 kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )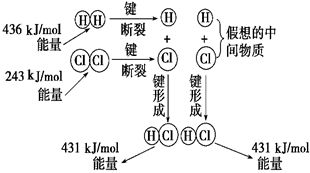
| A.1 mol H2中的化学键断裂时需要吸收436 kJ能量 |
| B.2 mol HCl分子中的化学键形成时要释放862 kJ能量 |
| C.此反应的热化学方程式为:H2(g)+Cl2(g)===2HCl(g) ΔH=+183 kJ/mol |
| D.此反应的热化学方程式为:H2(g)+Cl2(g)===HCl(g) ΔH=-91.5 kJ/mol |
已知:
根据以上热化学方程式判断,下列说法正确的是( )

| A. |
|
| B. |
上图可表示由
|
| C. |
|
| D. |
|
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)===CO(g)+3H2(g);ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g);ΔH=247.4 kJ·mol-1
2H2S(g)===2H2(g)+S2(g);ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与 H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为____________________________。
(2) H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是________________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:________________________。
(3) H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图中A.B表示的物质依次是________。
图1

图2
(4)电解尿素[CO(NH2)2 ]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴.阳极均为惰性电极)。电解时,阳极的电极反应式为 。
(5) Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为____________________________。
有下列两个反应,当温度降低时,反应a平衡右移,反应b平衡左移。
a、C2H2(g)+H2(g) C2H4(g) b、2CH4(g)
C2H4(g) b、2CH4(g) C2H4(g)+2H2(g)根据上述变化,判断以下几个热化学方程式:
C2H4(g)+2H2(g)根据上述变化,判断以下几个热化学方程式:
C(s)+2H2(g) CH4(g)△H= -Q1 kJ /mol
CH4(g)△H= -Q1 kJ /mol
2C(s)+H2(g) C2H2(g)△H= -Q2 kJ /mol
C2H2(g)△H= -Q2 kJ /mol
2C(s)+2H2(g) C2H4(g)△H= -Q3 kJ /mol
C2H4(g)△H= -Q3 kJ /mol
其中2Q1、Q2、Q3从大到小的顺序是( )
| A.2Q1>Q3>Q2 | B.Q3>2Q1>Q2 | C.Q2>Q3>2Q1 | D.Q3>2Q1>Q2 |
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。
根据上述数据可计算:N-H键的键能是 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________ 。
(1)用 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知: ====
==== △H=+64kJ/mol
△H=+64kJ/mol
 ====
==== △H= -196kJ/mol
△H= -196kJ/mol
 ="==="
="==="  △H= -286kJ/mol
△H= -286kJ/mol
在 溶液中
溶液中 与
与 反应生成
反应生成 和
和 的热化学方程式为 。
的热化学方程式为 。
(2)控制其他条件相同,印刷电路板的金属粉末用10℅ 和3.0 mol/L的
和3.0 mol/L的 混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
| |
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| |
铜平均溶解速率 |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
| |
( ) ) |
|
|
|
|
|
|
|
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(3)在提纯后的 溶液中加入一定量的
溶液中加入一定量的 和
和 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备 的离子方程式是 。
的离子方程式是 。
按要求完成各题
(1)已知,1mol N2(g)与足量O2(g)起反应,生成2mol NO2(g),吸收68 kJ的热量。该反应的热化学方程式可表示为:
(2)写出下列各物质的电离方程式:
CH3COOH
NH3·H2O  (3)写出下列各物质水解的离子方程式:
(3)写出下列各物质水解的离子方程式:
NaHCO3
AlCl3
(4)把足量的碳酸钙粉末放入水中,建立的溶解平衡可表示为:
I:(1)氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ·g-1。请写出氢气燃烧的热化学方程式 。
(2)1molN2(g)和1molO2(g)在一定条件下反应生成2molNO(g),吸收180kJ的热量,已知断裂1molN2(g)中的N≡N和1molO2(g)中的O=O分别需要吸收946kJ和498kJ的能量,则1molNO分子中的化学键形成时可释放_______kJ的能量。
Ⅱ:在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,如图所示:
(1)如果把电键K接A,这一装置形成 装置,Zn①极是_____极,其电极反应式是_______________________。
(2)上述反应进行5min后,转换电键K到C,这一装置形成________装置,Zn②极是_______极,其电极反应式是____________________;
(3)上述装置进行2min后,再转换电键K到B,在Zn②极上发生的腐蚀属于 ,Zn①极发生的腐蚀主要属于 。
在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
| A.CH3OH(l)+O2(g)===CO2(g)+2H2O(l)ΔH=+725.8 kJ/mol |
| B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=-1 452 kJ/mol |
| C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=-725.8 kJ/mol |
| D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=+1 452 kJ•mol‾1 |
下列说法正确的是
| A.需要加热才能发生的反应一定是吸热反应 |
| B.化学反应中的能量变化都表现为热量变化 |
| C.任何放热反应在常温下一定能发生反应 |
| D.反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
相同温度下,有下列三个热化学方程式:
(1)2H2(l)+O2(g)=== 2H2O(l) △H= -Q1 kJ• mol-1
(2)2H2(g)+O2(g)="==" 2H2O(l) △H= -Q2 kJ• mol-1
(3)2H2(l)+O2(g)=== 2H2O(g) △H= -Q3 kJ• mol-1
则Q1、Q2、Q3的关系表示正确的是( )
| A.Q1=Q2<Q3 | B.Q2 > Q1 >Q3 | C.Q3> Q2> Q1 | D.Q1=Q2=Q3 |
下列关于热化学反应的描述中正确的是( )
| A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热 △H=2×(-57.3)kJ/mol |
| B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol |
| C.△H>0,△S>0,在任何温度下都不可自发进行。 |
| D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |