下列关于能量转换的认识中不正确的是 ( )
| A.电解水生成氢气和氧气时,电能转化为化学能 |
| B.煤燃烧时,化学能主要转化为热能 |
| C.绿色植物进行光合作用时,太阳能转化为化学能 |
| D.白炽灯工作时,电能全部转化为光能 |
原高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
(1)两支试管均产生大量气体,盛 的试管中气体产生较快,盛 的试管中气球变得更大;
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3—(aq)+ H+(aq) ="===" H2O(l)+ CO2(g) △H>0
CO32—(aq)+ 2H+(aq) ="===" H2O(l)+ CO2(g) △H<0
甲下结论的方法是否正确 (填“正确”或“不正确”)
(3)为研究是吸热还是放热反应,乙同学继续进行了下列实验(每次实验各做3次平行实验,取平均值):
| 序号 |
试剂1 |
试剂2 |
混合 前温度 |
混合后最高 或最低温度 |
| ① |
35mL水 |
2.5g NaHCO3固体 |
20℃ |
18.5℃ |
| ② |
35mL水 |
3.2 Na2CO3固体 |
20℃ |
24.3℃ |
| ③ |
35mL稀盐酸 |
含2.5g NaHCO3的饱和溶液32.5mL |
20℃ |
19℃ |
| ④ |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶液23.1mL+10ml水 |
20℃ |
24.2℃ |
| ⑤ |
35mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
16.2℃ |
| ⑥ |
35mL稀盐酸 |
3.2g Na2CO3固体 |
20℃ |
25.1℃ |
请你帮助填写相关内容:
通过上述实验可得出五条结论
a:NaHCO3的溶解是 (吸热或放热)过程;
b:Na2CO3的溶解是 (吸热或放热)过程;
c:NaHCO3的饱和溶液和盐酸的反应是 (吸热或放热)反应;
d:Na2CO3的饱和溶液和盐酸的反应是 (吸热或放热)反应;
e:NaHCO3固体与稀盐酸反应的反应热是由 (填a→d的字母)的热效应之和。
(1)某温度(t℃)时,测得0.01 mol·L-1的NaOH溶液的pH=13,请回答下列问题:
①该温度下水的Kw=
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H=―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:_________________
(3)已知25°C时Ksp(Mg(OH)2)=1.8×10-11,为除去某食盐溶液中的Mg2+,可用NaOH为除杂试剂,当控制溶液pH=12时,可确保Mg2+ 除尽,此时溶液中Mg2+的物质的量浓度为
mol·L-1
A、B、C、D、E五种短周期元素的原子序数依次增大,上述元素中只有一种金属元素。A、B同周期,化合物AB2、DB2均是可使澄清石灰水变浑浊的气体。又已知C、E的单质均可溶于NaOH溶液,且C与NaOH溶液反应可产生气体。
(1)写出E元素的名称: E________
(2)画出C原子的原子结构示意图 ,写出AB2的结构式
(3)写出DB2使澄清石灰水变浑浊的化学方程式:_____________________
(4)写出E的单质与NaOH溶液反应的离子方程式:________________________________________
下列各组反应(表中物质均为反应物),在反应刚开始时,放出H2的速率最大的是
| |
金属(粉末状)/mol |
酸的浓度及体积 |
反应温度 |
| A |
Mg 0.1 |
3 mol·L-1硝酸10 mL |
80 ℃ |
| B |
Mg 0.1 |
1 mol·L-1盐酸10 mL |
60 ℃ |
| C |
Fe 0.1 |
1 mol·L-1盐酸 10 mL |
60 ℃ |
| D |
Mg 0.1 |
1 mol·L-1硫酸10 mL |
60 ℃ |
下列关于热化学反应的描述中正确的是 ( )
A.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)  2NH3(g)△H=-38.6kJ·mol-1 2NH3(g)△H=-38.6kJ·mol-1 |
| B.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1 |
| C.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g) =2CO(g)+O2(g)反应的 ΔH=+2×283.0 kJ·mol-1 |
| D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
下列说法不正确的是 ( )
| A.X+Y=M+N为放热反应,可推知X和Y的总能量一定高于M和N的总能量 |
| B.1molSO2的键能总和大于1mol硫和1mol氧气的键能之和 |
| C.由C(石墨)=C(金刚石)△H=+1.9KJ/mol可知,金刚石比石墨稳定] |
| D.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
市场上经常见锂离子电池,它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导的高分子材料。这种锂离子电池的电池反应式为:

。下列说法不正确的是( )
| A. |
放电时,负极的电极反应式:
|
| B. | 该电池不能用水溶液作为电解质 |
| C. |
充电时,
|
| D. |
放电过程中
|
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463kJ,则氢气中1 mol H—H键断裂时吸收热量为 ( )
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
下列说法或表示方法正确的( )
A.已知C(s)+O2(g)===CO2(g) ;C(s)+ ;C(s)+ O2(g)===CO (g) O2(g)===CO (g) ,则 ,则  |
B.在稀溶液中,H+(aq)+OH-(aq)===H2O(l)  kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热大于57.3 kJ kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热大于57.3 kJ |
C.由C(石墨)===C(金刚石); kJ·mol-1可知,金刚石比石墨稳定 kJ·mol-1可知,金刚石比石墨稳定 |
| D.已知氢气的标准燃烧热为-285.8 kJ·mol-1,相应的热化学方程式为2H2(g) + O2(g)=2H2O(l) ΔH = –285.8kJ·mol-1 |
下列关于反应能量变化的相关常识论断错误的是
| A.吸热反应不一定都要加热才反应 |
| B.化学键的断裂和形成是化学反应中能量变化的根源 |
| C.选择燃料只需考虑燃料热值大小 |
| D.若反应物的总键能大于生成物的总键能则反应为吸热反应 |
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1 mol产物的数据)。
根据上图回答下列问题:
(1)PCl3分解成P(s)和Cl2(g)的热化学方程式是__________________________________。
(2)P和Cl2分两步反应生成1 mol PCl5的△H1=_______________,与P和Cl2一步反应生成1 mol PCl5的△H2的关系是:△H2__________△H1(填“大于”、“小于”或“等于”)。
已知石墨在高温、高压及催化剂存在的条件下能转化为金刚石,该反应为吸热反应,由此可知
| A.石墨比金刚石稳定 | B.石墨总能量比等质量的金刚石高 |
| C.该变化属于物理变化 | D.该反应的焓变△H<0 |

反应过程的能量变化如图所示。已知1
氧化为1
的
.请回答下列问题:
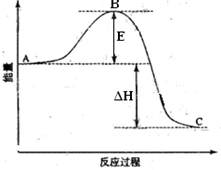
(1)图中点表示。
的大小对该反应的反应热有无影响。该反应通常用
作催化剂,加
会使图中
点升高还是降低,理由是;
(2)图中=
;
(3)的催化循环机理可能为:
氧化
时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式
,。