已知热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH1=-483.6 kJ/mol,则对于热化学方程式:2H2O(l)===2H2(g)+O2(g) ΔH2,下列说法正确的是
| A.热化学方程式中化学计量数表示分子个数 |
| B.该反应的ΔH2=+483.6 kJ/mol |
| C.|ΔH2|<|ΔH1| |
| D.|ΔH2|>|ΔH1| |
化学能的转化在现实生活中得到了广泛的利用。回答以下问题:
(Ⅰ)(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧的热化学方程式: 。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1=" —702" kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2=" —182" kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3= 。
(3)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 
(Ⅱ)下图为相互串联的甲乙两个电解池:
请回答:
(1)甲池若为用电解原理精炼铜的装置,则:
A极是 极,材料是 ,电极反应为 ,
B极是 极,材料是 ,电极反应为 ,
电解质溶液为 。
(2)乙池中若滴入少量酚酞试液,开始一段时间后,Fe极附近呈 色。
(3)若甲槽阴极增重12.8g,则乙槽阳极放出气体在标准状况下的体积
_________________。
(4)同时若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为
__ _____。
利用化学反应原理研究生产、生活中的实际问题具有十分重要的意义:
(Ⅰ)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g)  2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
(1)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量_____92 kJ(填“大于”“等于”或“小于”),原因是_______;若加入催化剂,ΔH (填“变大”“变小”或“不变”)。
(2)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为______kJ。
(3)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4完全反应的热化学方程式为 。
(Ⅱ)某铅蓄电池的正、负极标记被磨损。试用下图装置设计实验,识别出此铅蓄电池的正负极。
(1)若A接E,B接F,而B电极出现 ,反应式为 ,则说明F为正极;
(2)若铅蓄电池工作时(放电),其E所在电极的电极反应式为: ,充电时该极与外加电源的 极相连。
(3)若用该电池电解Cu(NO3)2 溶液,其电解方程式为
若有0.2mol电子发生转移,则正极消耗的PbO2的物质的量是 ;要想CuSO4溶液恢复原样,需加入的物质是 ,质量为
已知反应:①101kPa时,C(s) + 1/2O2(g)=CO(g) △H1=-110.5kJ/mol
②稀溶液中,H+(aq) + OH-(aq)=H2O(1) △H2=-57.3kJ/mol
下列结论正确的是( )
| A.若碳的燃烧热用△H3来表示,则△H3<△H1 |
| B.若碳的燃烧热用△H3来表示,则△H3>△H1 |
| C.浓硫酸与稀NaOH溶液反应的中和热为57.3kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ/mol
下列说法错误的是
| A.1mol CH3OH(g)完全燃烧放出的热量大于192.9 kJ |
| B.根据反应①和②推知反应: H2(g)+1/2O2(g)=H2O(g)的△H=-241.9kJ/mol |
| C.CH3OH转变成H2的过程不一定要吸收能量 |
| D.反应①中的能量变化如图所示 |

已知下列热化学方程式:
①CaCO3(s)=CaO+CO2(g);△H=177.7KJ
②C(s)+H2O(s)=" CO(g)+" H2(g);△H=-131.3KJ/mol
③ H2SO4(l)+NaOH(l)=
H2SO4(l)+NaOH(l)=  Na2SO4(l)+ H2O(l);△H=-57.3KJ/mol
Na2SO4(l)+ H2O(l);△H=-57.3KJ/mol
④C(s)+O2(g)= CO2(g) ;△H=-393.5KJ/mol
⑤CO(g)+  O2(g)= CO2(g);△H=-283KJ/mol
O2(g)= CO2(g);△H=-283KJ/mol
⑥HNO3(aq)+ NaOH(aq)= NaNO3(aq)+H2O(l) ;△H=-57.3KJ/mol
⑦2H2(g)+O2(g)=2H2O(l):△H=-517.6KJ/mol
(1)上述热学方程式中,不正确的有 ,(填编号),不正确的理由分别是 。
(2)根据上述信息,写出C转化为CO的热化学方程式 。
(3)上述反应中,表示燃烧热的热化学方程式有 (填编号)表示中和热的热化学方程式有 。(填编号)
50ml 0.5mol·L-1的盐酸与50ml 0.55mol·L-1的NaOH 溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
请回答下列问题:
(l)从实验装置上看,由图可知该装置有不妥之处,应如何改正? 。
(2)烧杯间填满碎纸条的作用是 。
(3)如果不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用 60 mL 0.50 mol· L-1的盐酸跟 50mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
(5)用相同浓度和相同体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会 (填“偏大”“偏小”“无影响”);
简述理由 。
(每空格2分,计6分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ·mol-1。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 KJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
充分燃烧7g乙烯(C2H4)气体生成CO2气体和液态H2O,放出b kJ的热量,则相同条件下乙烯燃烧的热化学方程式正确的是
| A.C2H4(g)+3O2(g) = 2CO2(g) +2H2O(l)△H = -2b kJ·mol-1 |
| B.C2H4(g)+3O2(g) = 2CO2(g) +2H2O(l)△H = +2b kJ·mol-1 |
C. C2H4(g)+ C2H4(g)+ O2(g) = O2(g) = CO2(g)+ CO2(g)+ H2O(l)△H = +b kJ·mol-1 H2O(l)△H = +b kJ·mol-1 |
| D.C2H4(g)+3O2(g) = 2CO2(g) +2H2O(l)△H = -4b kJ·mol-1 |
下列对化学反应的认识,不正确的是
| A.化学反应必然引起物质状态的变化 |
| B.化学反应涉及化学键的断裂和生成,而且还伴随着能量的变化 |
| C.化学反应速率的大小主要取决于反应物的性质 |
| D.若反应物的总能量低于生成物的总能量,则该反应是吸热反应 |
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(1) △H=-akJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(1) △H=-bkJ·mol-1
2H2 S(g)+O2(g)=2S(s)+2H2O(g) △H=-ckJ·mol-1(a、b、c均为正数)
S(g)+O2(g)=2S(s)+2H2O(g) △H=-ckJ·mol-1(a、b、c均为正数)
对a、b、c三者大小关系的判断正确的是
| A.a>b>c | B.a>c>b | C.c>b>a | D.b>a>c |
工业上金属的冶炼过程复杂。
(1)炼铁涉及的2个热化学方程式: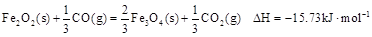
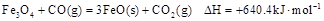
则反应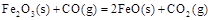 的
的 。
。
(2)工业上电解硫酸锌溶液可实现湿法炼锌(控制条件,使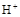 难放电、阳极电极不溶解)。写出电解总方程式 。
难放电、阳极电极不溶解)。写出电解总方程式 。
(3)将干净的铁片浸于熔融的液态锌水中可制得镀锌钢板,这种钢板具有很强的耐腐蚀能力。镀锌钢板的镀层一旦被破坏后,锌将作为原电池的 极发生 反应。(填“氧化”或“还原”)
(4)实验室用镀锌钢板与稀硫酸制取标准状况下的氢气4.48L,则该反应转移的电子数为
,消耗硫酸的物质的量是 。
已知两个热化学方程式: C(s)+O2(g)==CO2(g) △H = -393.5kJ/mol
2H2(g)+O2(g)==2H2O(g) △H = -483.6kJ/mol
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是
| A.1:1 | B.1:2 | C.2:3 | D.3:2 |
下列有关化学方程式的叙述正确的是( )
A.已知2H2(g) + O2(g) ="==" 2H2O(g) △H=-483.6kJ/mol, 则氢气的燃烧热为241.8 kJ/mol
B. 已知C(石墨, s) ="==" C(金刚石,s) △H>0,则金刚石比石墨稳定
C. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+ HCl(aq) ="==" NaCl(aq) + H2O(l) △H="-57.4kJ/mol"
D.已知2C(s)+2O2(g) ===2CO2(g) △H12C(s)+ O2(g) ===2CO(g) △H2 则△H1>△H2