中学化学常见的物质A、B、C、D之间存在如下转化关系:
A + B → C + D + H2O。请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体,
C、D两种气体均能使澄清石灰水变浑浊,则A与B反应的方程式是 ,已知具有刺激性气味的C气体和Cl2都能漂白某些有色物质,如果将两种气体等物质的量通入到品红溶液中的实验现象为 原因是 。
如果将两种气体非等量通入到水中,为了验证哪种气体过量,某兴趣小组的同学准备了以下试剂: ① 氯化铁溶液 ② 氯化亚铁溶液 ③ 硫氰化钾溶液 ④ 苯酚溶液
⑤ 品红溶液 ⑥ 酸性高锰酸钾溶液
若Cl2过量:取适量溶液滴加至盛有 (选填一个序号)试剂的试管内,再加入
(选填一个序号)试剂,发生的现象是: ;
若C过量:取适量溶液滴加至盛有 (选填一个序号)试剂的试管内,发生的现象
是: 。
(2)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;C是漂白粉的有效成分,则C发生水解反应的离子方程式是 。
(3)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体。检验A中阳离子的方法是
(简述操作过程及结论)。
反应①②是重要的化工反应,D、E、F、G为单质,D、E、G、H为气体,且只有E为有色气体,F是常见的金属单质,G是空气中主要成分之一,K是白色胶状沉淀,C的焰色反应为黄色,其物质间的转化关系如下,虚框内是需设计的内容,反应物只能用A~J中的物质:
(1)A的电子式 , H的结构式是 ;
(2)A溶液的电解方程式是 ;
C+B→J的离子方程式是 ;
(3)请设计F→K的最佳途径
(4)按设计得到1mol K,电解B时转移的电子数目是 ,至少需要另加试剂的物质的量是 : mol, : mol, : mol(可不填满)。
某白色粉末A在农业上用作杀菌剂,进行下列实验:
(1)白色粉末溶解在水中,得到蓝色溶液,分成等量的两份
(2)在其中一份蓝色溶液中加入适量的盐溶液B,恰好沉淀完全,过滤,得到白色沉淀和蓝色溶液;向该蓝色溶液中加入AgNO3并加入HNO3,生成白色沉淀且不溶解。
(3)在另一份蓝色溶液中加入适量C溶液,恰好沉淀完全,过滤,得到蓝色沉淀和纯净的硫酸钾溶液。
根据实验现象推断:
A B C
如下图所示物质间的相互转变关系,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应.常温下D、E、G均是气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%.
请回答下列问题:
(1)写出F的化学式:________________.
(2)人们将反应①涉及的化学工业称为 ________________.
(3)写出B与D反应的离子方程式____________________________________ ____.
____.
(4)写出反应④的离子方程式____________________________ __________________.
__________________.
(5)写出反应⑤的离子方程式_____________________________________________ _.
_.
(6)高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为:
①Na2FeO4具有强氧化性可杀菌消毒;
②___________________________________________________________________
22.A、B、C、D均为中学化学中常见的物质,它 们之间的转化关系如下图(部分产物已略去):
们之间的转化关系如下图(部分产物已略去):
试回答:
(1)若D是具有氧化性的单质,A元素属于主族金属元素,则A为________(填元素名称).
(2)若D是金属,C溶液在储存时应加入少量D,其理由是(用必要的文字和离子方程式表示)_____________ _______________________________________;D在潮湿的空气中易发生吸氧腐蚀,写出腐蚀时原电池正极的电极反应式:_________
_______________________________________;D在潮湿的空气中易发生吸氧腐蚀,写出腐蚀时原电池正极的电极反应式:_________ ___________________.
___________________.
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C 反应生成 B.
反应生成 B.
请写出B转化为C的所有可能的离子方程式:________________________________、___________________________________.
某溶液 仅含下表离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1mol。
仅含下表离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1mol。
| 阳离子 |
Na+ Mg2+ Fe3+ Al3+ Fe2+ |
| 阴离子 |
OH- CO32- Cl- NO3- SO42- |
①若向溶液中加入KSCN溶液无明显变化;
②若向原溶液中加入稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,且溶液中阴离子种类不变;
请推断:
(1)原溶液中含有阳离子: ;含有阴离子: ;
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式: ;
(3)若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g。
有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:
① 将白色粉末加水溶解,得无色溶液。
② 向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向
滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B。
根据上述现象判断:
A的化学式是 B的化学式是
(2)原白色粉末中一定含有 ,可能含有 ,
对可能含有的物质,可通过 (填实验名称)进一步检验。
在一定条件下可实现下图所示物质之间的变化: 请填写以下空白:
请填写以下空白:
(1)已知孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解.
写出A与足量的F反应的离子方程式_ .
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式__________________.
(3)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式:
.
(4)每生成1mol D,同时生成______mol E.
室温下,单质A 、B、C分别为常见金属、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的。
、B、C分别为常见金属、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的。
请回答下列问题:
(1)A是 B是 ;(填化学式)
(2)反应①的化学方程式 ;
(3)反应③的化学方程式 ;
(4)反应④的化学方程式为 ;
A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去)
(1)若D为白色胶状难溶物,且与A摩尔质量相等,则反应③的离子方程式为: 。
(2)若A为CO,则D的化学式为 。
(3)若C为当今需要减排的一种常见的温室气体,E为一种弱酸,则A的化学式为 。
A—J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。回答下列问题:
(1)B中的化学键有 ,(填“离子键”、“极性键”或“非极性键”) E的电子式 。
(2)写出反应⑦的离子方程式__________________________
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式_____________________
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在_____________(填“阴或阳”)
极附近溶液由无色变为红色,其原因是
A、B、C、D、E、F、G、H、I、J、K都是中学课本常见物质,它们与X具有下图相互转化关系。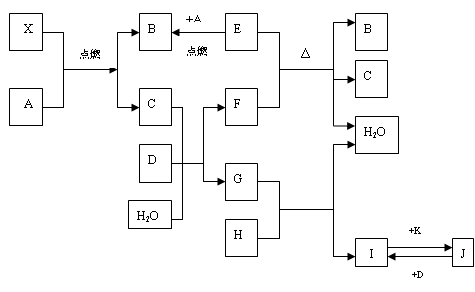
已知:①A、D、E、K为单质,其中E为黑色固体;
②X、A、B、C、D为气体,B、C均能使澄清石灰水变浑浊,C、D均能使品红溶液褪色;
③H是一种红棕色固体氧化物。
请回答下列问题:
(1)B分子的电子式:_______________;
(2)J与氨水反应的离子方程式:_______________________________________;
反应全过程的现象是:_____________________________________________;
(3)E和F反应的化学方程式:__________________________________________;
(4)气体X中含有三种元素,分子中各原子均达到8电子稳定结构,其对H2的相对密度为30,试推断X的分子式:___________;X的结构式:____________。
已知A、B、C是单质,其中A是金属,各物质间的转化关系如图:
回答下列问题:(1)写出下列物质的化学式(各1分):
(1)A:________、B:________、乙:________、
丙:________、丁:________、戊:________
(2)写出A与NaOH溶液的化学方程式 ;
写出丁生成戊的离子方程式 ;
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有
如图所示的转化关系(部分产物及反应条件已略去)。下列推断正确的是 ( )
A.X元素为铝
B.反应①和②互为可逆反应
C.X元素可能是金属,也可能是非金属
D.反应①和②一定为氧化还原反应