A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去)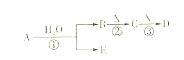
(1)若D为白色胶状难溶物,且与A摩尔质量相等,则反应③的离子方程式为: 。
(2)若A为CO,则D的化学式为 。
(3)若C为当今需要减排的一种常见的温室气体,E为一种弱酸,则A的化学式为 。
A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去)
(1)若D为白色胶状难溶物,且与A摩尔质量相等,则反应③的离子方程式为: 。
(2)若A为CO,则D的化学式为 。
(3)若C为当今需要减排的一种常见的温室气体,E为一种弱酸,则A的化学式为 。