下列A~H 八种物质存在如下图所示的转化关系(反应条件、部分产物未标出)。已知A是正盐,B能使品红溶液褪色,G是红棕色气体。
试回答下列问题:
(1)写出下列各物质的化学式 A
(2)按要求写出下列反应的有关方程式
E→F反应的化学方程式 ;
G→H反应的离子方程式 。
(3)写出H的浓溶液与木炭反应的化学方程式 。
(4)检验D中阴离子的方法是
下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、D是金属单质,L为红褐色沉淀,E为食盐的主要成分,I的水溶液呈强酸性。
(1)K的化学式为______________________________。
(2)写出反应①的化学方程式:______________________________________。
(3)写出反应②的离子方程式:______________________________________。
(4)向M溶液中加入足量的I溶液反应的离子方程式为______________________。
(5)写出一个由化合反应生成L的化学方程式______________________________。
(12分)中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,C在常温下为无色的液体,D是红棕色气体。(图中部分产物和反应条件已略去)
回答下列问题:
(1)写出甲与A的浓溶液反应的化学方程式_________________________________。
(2)C的电子式是___________________________。
(3)除去G固体中含有H杂质采用的方法是_____________________。
(4)A溶液与一种能使湿润的红色石蕊试纸变蓝的气体反应,生成一种盐,该盐的溶液呈酸性,其原因是(用离子方程式表示)_____________________________。
(5)写出由F转化为E的离子方程式____________________________________;
(6)写出由G转化为H的离子方程式____________________________________。
.下列转化关系图中,A、B、C、D、E常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物。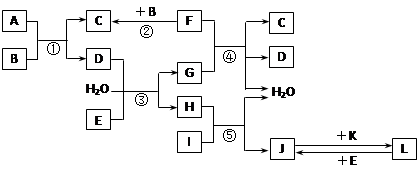
请回答下列问题:
⑴C的电子式为 。
⑵检验溶液L中金属阳离子的方法是 。
⑶反应③的离子方程式为 。
⑷F与G的浓溶液反应的化学方程式为 。
⑸气体A的密度为2.68g·L-1(标准状况),通过计算、推理,可确定A的分子式为 。
. A 、B、 C、 D、 E是中学常见的5种化合物,A 、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
(1)X的单质与A反应的化学方程式是
(2)若试剂1和试剂2均是稀硫酸。
①如何验证D中的金属离子已全部转化为E:
②物质C溶于水有净水作用,原因是:
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠
为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是
(3)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是
. 在某澄清、透明的黄色溶液中,可能含有NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、I- Cl-离子。进行下述实验(所加试剂均过量)。
(1) 沉淀 A的化学式是 ,气体A的化学式是 ;
(2)待测液中一定存在 ;一定不存在 _______ 用离子方程式表示上述离子一定不存在的原因 。
(3)写出溶液C与过量氨水反应的离子方程式 。
(4)若气体A、沉淀A、沉淀D的物质的量各为1mol,则SO42-的物质的量为: mol
(8分)在一定条件下可实现下图所示物质之间的变化:
请填写以下空白:
(1)孔雀石的主要成分是Cu2(OH)2CO3,受热易分解。上图中的F的电子式为 。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式 。
(3)图中所得G和D都为固体,混和后在高温下可发生反应,写出该反应的化学方程式 。
(4)D与NaOH溶液反应的离子方程式为 。
图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。 回答下列问题:
回答下列问题:
(1)组成单质X的元素在周期表中的位置是 ;M中存在的化学键类型为 ;
(2)一定条件下,Z与H2反应生成ZH4的结构式为 。
(3)已知A与1molAl反应转化为X时(所有物质均为固体)。放出aKJ热量。写出该反应的热化学方程式: 。
(4)写出M和D的稀溶液反应生成R的离子方程式:
(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列全)。
请回答下列问题:
(1)B的电子式为 。
(2)J、K是同种金属的氯化物,且K为白色沉淀。写出SO2还原J生成K的离子方程式 。
(3)汽车尾气中常含有D。B与D在加热和催化剂存在的条件下,发生反应生成两种对空气无污染的物质。请写出该反应的化学方程式 。
(4)有人认为:“表面化学”研究成果能使B和D的反应在催化剂表面进行时的效率大大提高,从而使污染物D的转化率大大提高。请你应用化学基本理论对此观点进行评价: 。
A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知: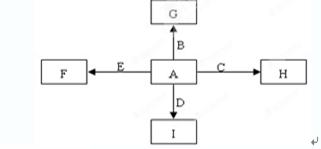
①反应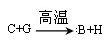 能放出大量的热,该反应曾应用于铁轨的焊接;
能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和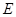 可以发生反应:2E+I
可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为_______________________________;
(2)化合物Ⅰ的电子式为______________________,
(3)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量(写出化学方程式和计算结果); ,
(4)C与过量NaOH溶液反应的化学方程式为__________________,反应后溶液与过量化合物Ⅰ反应的化学方程式为_____________________________;
(5)E在I中燃烧可能观察到的现象是__________________________。
(12分)A、B、C、D均为中学化学中常见的物质,它们之间的转化关系如下图(部分产物已略去):
试回答:
(1)若D是具有氧化性的单质,A元素属于主族金属元素,则A为________(填元素符号)。
(2)若D是金属,C溶液在储存时应加入少量D,其理由是(用必要的文字和离子方程式表示)____________________________________________________;D在潮湿的空气中易发生吸氧腐蚀,写出腐蚀时原电池正极的电极反应式: 。
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子方程式:
______________________________、_________________________________。
A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知
A是一种高熔点物质,B为空气的成分之一,D是一种红棕色固体。请回答下列问题:
(1)固体A的晶体类型为___________,K的化学式为 。
(2)C与D在高温下的反应在冶金工业上称为 反应,引发该反应的实验操作是
(3)G→J的化学方程式为____________。
(4)A→H的离子方程式为 。
(5)I的水溶液pH_____7(填“>”、“<”或“=”),原因是____________(用离子方程式表示)。
.A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有有色气体生成,则C的电子式为 ,反应④的化学方程式为: 。
(2)若A为常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 ,用电子式表示B分子的形成过程 。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为 ,分子E的结构式为 。
.A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中非金属与金属元素的原子个数比为1:2.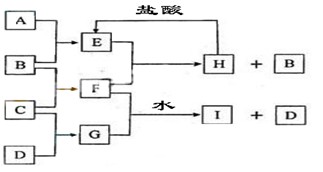
如图所示(图中部分产物末列出):请填写下列空白:
⑴ A是 ,C是————————————
⑵物质F的电子式 , 物质B的结构式
⑶H与盐酸反应生成E的化学方程式是————————————
(4) E与F反应的化学方程式是——————————————————.
在下列各变化中,E为常温下无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。
回答下列问题:
(1)写出H的电子式:
(2)若反应①在加热条件下进行,A为单质,C为无色有刺激性气味的气体,D为无色无味的气体,且C、D两种气体均能使澄清的石灰水变浑浊,则反应①的化学方程式是 。
①实验需要检验出C、D、E三种气体产物,三种气体检验的先后顺序是 (用化学式填空),在检验D气体前,需除去C气体,所用试剂是 ,反应的离子方程式是 。
②已知:A(s)+O2(g) =AO2(g) △H=-393.5kJ·mol-1
2A(s)+O2(g) =2AO(g) △H=-221.0kJ·mol-1
则AO的燃烧热的热化学方程式___________________________________.
③AO2在自然界循环时可与碳酸钙反应,碳酸钙是一种难溶物质,它的Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸产生能使品红溶液褪色的气体,在加热条件下,当A过量时,反应①的离子方程式是 。
(4)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,当A过量时,C及D均易溶于水,则A过量时反应①的离子方程式是 。