在一定条件下,某些化学反应可以下图框架表示,根据要求回答下列问题:
(1)若A、C、D均为含氯物质,且A的化合价介于C和D之间,D具有漂白性,写出该反应的离子方程式 ;
(2)若通过电解的方法获得黄绿色气体C,则该反应的离子方程式为
(3)若C、D均为气体且均能使澄清石灰水变浑浊,写出符合上述框图要求的化学方程式
(4)若A为红色金属单质,B为第二周期某种元素的最高价氧化物的水化物的稀溶液,
写出符合上述框图关系的离子方程式 。
(10分) A、B、C、D、E、F、G七种物质间存在如图所示转化关系,其中A、B、D、G含有同种元素。已知:A为金属单质,C为黄绿色气体;D能将某种非金属氧化物氧化为F,F是含有三种元素的化合物。请回答下列问题:
(1) 以上反应中属于化合反应的是___________________ (填序号)
(2) G生成B的过程中所出现的现象
(3)反应⑦的化学方程式为_________________________________
(4)反应③的离子方程式
(5)D的水溶液显_____性,请用离子方程式解释原因 ____________________
物质A~Z有下图所示的转化关系(部分反应物与产物已略去)。其中,常温下B、C为气体单质,Y为固体单质,Y是电子工业中常用的半导体材料。F是具有磁性的黑色晶体。E的水溶液与M混合后得到N,N经过干燥脱水可得到一种常用于实验室和袋装食品、瓶装食品等的干燥剂,K的焰色反应为紫色,A的焰色反应为黄色。
请回答:
(1)利用①反应进行化工生产的工业名称为 ,K的化学式 ;D的电子式________________;
(2)反应①的离子方程式 ;
(3)向H的水溶液中加入足量氨水并将溶液露置在空气中,观察到的现象是 ;向相同体积相同浓度的两份G溶液中分别滴加相同PH的氨水和D溶液,当沉淀最大量时所加入的氨水和D溶液的体积分别为V1、V2,则V1、V2的大小关系V1 V2。
(4)写出反应⑥的化学方程式 。
(5)N为比碳酸还弱的酸,设计实验证明,简述实验过程和现象 。
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。
已知: A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)D的化学式为 ;F的电子式为 。
(2)A与B生成D的反应在工业上是生产 的反应原理之一。
(3)E与G的稀溶液反应的离子方程式为 。
(4)B和C反应的化学方程式为 。
(5)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子
方程式 。
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素。已知:(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液。
(Ⅱ)D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
(Ⅲ)D能将某种氧化物氧化为F,F是含有三种元素的化合物。
请回答下列问题:
(1)上述反应中属于置换反应的是 (填序号)。
(2)G生成B有多种途径。若在G的溶液中加入与G等物质的量的Na2O2,恰好使G转化为F,写出该反应的离子方程式:
反应③(即D将某种氧化物氧化为F)的离子方程式
(3)实验室制取C的化学方程式为
对气体C进行如下实验。已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023 个。请按照要求填空:
| 实验步骤 |
实验现象 |
用化学用语解释 |
| 将少量气体通入淀粉KI溶液 |
溶液最初变成 色 |
(用离子方程式表示) |
| 继续通入气体 |
溶液逐渐变成无色 |
(用化学方程式表示) |
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀。
(1)B中所含元素位于周期表中 族。 (2)A在B中燃烧的现象是 。
(3)D + E → B的反应中,被氧化与被还原的物质的量之比是 。
(4)G + J → M的离子方程式是 。(5)Y受热分解的化学方程式是 。
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属, K是一种红棕色气体。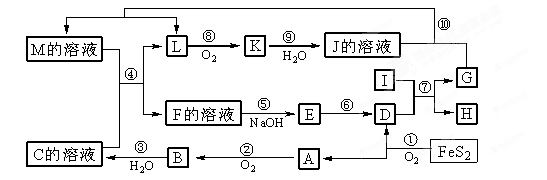
(提示:4FeS2+11O2 2Fe2O3+8SO2)
2Fe2O3+8SO2)
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第__________周期_________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
(3)在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是___________(填序号)
(4)反应④的离子方程式是:______________________________________________。
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:___________________________________。
现有常见金属单质A、B、C和常见气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
⑴写出下列物质的化学式:
A B F 丙
⑵写出下列反应离子方程式:
反应③
反应⑤
反应⑥
下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。
已知:
①反应 能放出大量的热,该反应曾应用于铁轨的焊接;
能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和 可以发生反应:2E+I
可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为________________________________;
(2)化合物Ⅰ的电子式为______________________,它的空间构型是_________;
(3)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量______________________;
(4)C与过量NaOH溶液反应的离子方程式为_______________________,反应后溶液与过量化合物Ⅰ反应的离子方程式为_______________________;
(5)E在I中燃烧观察到的现象是______________________。
下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C。 H可用作工业上冶炼金属的还原剂。请按要求填空:
(1)写出下列物质的化学式:A:________;B:________;C:________.
(2)写出F+B→I的化学方程式_________________________________.
(3)写出G和I的浓溶液反应的化学方程式_________________________
(16分)图中X、Y、Z为单质,其他为化学物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。
回答下列问题:
⑴组成单质Y的元素在周期表中的位置是 ;M中存在的化学键类型 为 ;R的化学式是 。
⑵一定条件下,Z与H2反应生成ZH4,ZH4的电子式为 。
⑶已知A与1molAl反应转化为X时(所有物质均为固体)。放出a KJ热量。写出该反应的热化学方程式: 。
⑷写出A和D的稀溶液反应生成G的离子方程式: 若转移0.6mol电子,生成的气体在标况下体积为
⑸向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。
化合物A为一种常见金属元素与一种常见非金属元素组成的化合物,阳离子与阴离子的个数比为2:3。K为常见固态非金属单质,J为常见气态单质。其余为化合物,其中I、F在常温下为液态, C为臭鸡蛋气味气体,D为刺激性气体,H无色无味气体,B为白色胶状沉淀,L为氯碱工业中的常见产品。F的浓溶液与K加热可生成D和H。(部分生成物未标出)
(1)写出H的电子式
(2)写出下列物质的化学式: E J
(3)写出下列变化的化学方程式:
A + I → B + C
F的浓溶液与K加热可生成D和H
(4)写出下列变化的离子方程式:
B中加入L的水溶液
G的水溶液中通入过量的H
下图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。试回答下列问题:
(1) 工业上,在电解A溶液的设备中将阴极区和阳极区用 隔开。(填设备名称)
(2) 写出A的水溶液电解的离子方程式 。
(3) 写出K与CO2反应的化学方程式 。
(4) Y与NaClO和B的混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,写出该反应的离子方程式 。
(5) 一定量的Z与N的混合物分为两等分,一份直接与足量氢氧化钠溶液产生气体为amol,另一份高温下充分反应(不考虑固体与氧气的反应)后的固体混合物与足量盐酸产生气体为bmol,现有a:b=9:7,则混合物中Z与N的物质的量之比为 。
A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
(1)常温下,若A为气态单质,C为非金属氧化物,A、C均能使品红溶液褪色,相对分子质量E>D,则该反应的化学方程式为:______,检验D中阴离子所用试剂为: 。
(2)若A为短周期的金属单质,D为气态单质,C溶液呈酸性或强碱性时,该反应都能进行。写出A与强碱溶液反应的离子方程式:
(3)若A、C均为化合物,C为引起温室效应的主要气体且过量,E为白色胶状沉淀,写出E可能的物质的化学式: 或 。写出其中一个生成E的离子方程式: 。
如下图的转化关系中,已知A是由短周期元素组成的酸式盐。D、Y、H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。
试回答下列问题:
(1)D的电子式为:___________________;
(2)写出D+H+X→A的化学方程式:________________________________;
(3)写出C→H的离子方程式:_______________________________;
(4)写出D与K反应生成的正盐的化学式:_____________;
(5)已知1molH(g)完全转化为I(g)时放热98.3kJ,则此反应的热化学方程式为____________________________;某条件下,当加入4 mol H和2 mol Y后,放出314.56 kJ的热时,此时H的转化率为__________;
(6)一定温度下,有可逆反应:aD(g)+bY(g) cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。