(10分)有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复) 提示:CH3COONH4溶液为中性
| 阳离子 |
Na+、Ba2+、NH4+ |
| 阴离子 |
CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是______ ,B是_______ ,C是_______ ,D是________ 。
(2)用离子方程式表示A的水溶液显碱性的原因________________________________。
(3)25℃时,0.1mol·L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= _______(用含a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为____________ _______。
气体A只含X、Y两种短周期元素,X的原子序数大于Y的原子序数。B、D、E是中学化学中的常见气体。各物质有如下图所示的转化关系: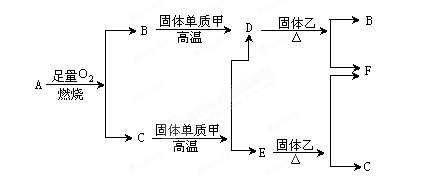
试回答下列问题:
(1)若气体A中,X与Y的质量比小于3,则气体A中肯定有( )(写化学式)
(2)若气体A的分子为线形结构,且X与Y的质量比在数值上等于X的相对原子量,则A的化学式为( )
(3)写出化学式:B________ C________ D________ E________ 甲________
已知A为常见金属,X.Y为常见非金属,X.E.F.G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(1)利用反应6NO2+8NH3  7N2+12 H2O可处理大气中的污染物NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O可处理大气中的污染物NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
已知:2SO2(g)+O2(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1
2NO2(g) ΔH="-113.0" kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
(2)物质A~E都是中学化学中常见的物质,它们可发生如图所表示的反应:
在以上反应中(用序号填空):属于氧化还原反应的是 ;属于复分解反应的是 。反应③的离子方程式为 :
若以反应⑦设计一个原电池,则原电池的负极材料应为 。
现有常见金属单质A、B、C和常见气体甲、乙、丙及物质D、E、F、G、H、I,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
⑴写出下列物质的化学式: A B F 丙
⑵写出下列反应离子方程式:
反应③
反应⑤
(3)写出反应⑧的化学方程式
(4)判断物质E是否是电解质 (填“是”或“否”)
A~H是由短周期元素组成的单质或化合物,其中A是淡黄色固体化合物,B是生活中最常见的无色液体,D是地壳中含量最多的金属元素的单质,F是典型的两性氧化物。它们之间的转化关系如下(部分生成物已略去):
请回答下列问题
⑴写出下列物质的化学式:A 、B 、C 、 E
⑵写出C+D→F的化学方程式: ;
⑶G→H的反应过程中能观察到有 色的沉淀生成;H→G的离子方程式是:
。
(共8分)现有A、B、C、D、E、F六种物质,它们的相互转化关系如下图所示。已知A和B是单质,B、E、F在常温下为气体,C为淡黄色固体。
(1)写出A、B的化学式:A ,B
(2)写出A生成C的化学方程式
(3)写出C与D反应生成E的化学方程式
(12分)已知有以下物质相互转化

试回答:
(1)写出B的化学式__________;D的化学式__________。
(2)写出由E转变成F的化学方程式_______________________________。
(3)写出用KSCN鉴别G溶液的现象_________;向G溶液加入A的有关离子反应方程式_________________________________________。
(6分)室温下,单质A.B、C分别为金属单质、黄绿色气体、无色气体,在一定的条件下,它们可以按下列框图进行反应。又知D溶液是黄色的。请回答:
(1)写出下列物质的化学式:A________________,B____________。
(2)反应①的化学方程式:________________________________。
(3)反应④的离子方程式:________________________________。
(9分)有一包白色粉末状混合物,可能含有Na2CO3、NaCl、CaCO3、CuSO4、KCl、Na2SO4、MgCl2、KNO3中的某几种,现进行如下实验:
①将混合物溶于水,得到无色透明溶液。
②取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加上稀硝酸,沉淀不溶解,在另一份中加入NaOH溶液,也产生白色沉淀。
根据上述实验现象回答:
(1)原混合物中肯定没有__________________________。
(2)原混合物中肯定有____________________________。
(3)不能确定是否含有____________________________。
已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z、W四种元素的符号:
X 、Y 、Z 、W
(2)由以上元素中的两种元素组成的能溶于水产生气体且水溶液显碱性的化合物的电子式为 。
(3)由X、Y、Z所形成的离子化合物是 ,它与W的最高氧化物的水化物的稀溶液反应的离子方程式是 。
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下图所示进行反应,又知E溶液是无色的。
请回答:(1)(写化学式)A是 ,B是 ,C是 。
(2)反应①的化学方程式 。
(3)反应③的化学方程式 。
(4)反应④的离子方程式 。
(9分)根据右图物质之间的转化关系,回答:
(1)写出A、B、C的化学式:
A___________;B___________;C___________。
(2)写出下列各步的化学反应方程式:
A→B:_____________________________________;
A→Cu:____________________________________。
B→C:_____________________________________。
下已知A~K均为中学化学中的常见物质,它们之间的转化关系如下图所示,其中A、D为金属单质,反应过程中生成的水及其他部分产物已略去。
请回答以下问题:
(1)E中阳离子的结构示意图为 。
(2)CO2的电子式为 。
(3)向F中通入足量CO2生成K的离子方程式 。
(4)写出H在空气中生成I的化学方程式 。
( 5 )写出E到F的离子方程式 。