(12分)已知有以下物质相互转化
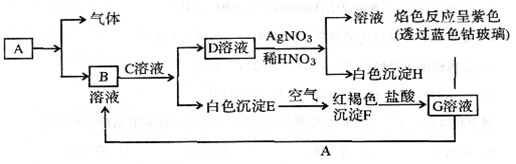
试回答:
(1)写出B的化学式__________;D的化学式__________。
(2)写出由E转变成F的化学方程式_______________________________。
(3)写出用KSCN鉴别G溶液的现象_________;向G溶液加入A的有关离子反应方程式_________________________________________。
(12分)已知有以下物质相互转化

试回答:
(1)写出B的化学式__________;D的化学式__________。
(2)写出由E转变成F的化学方程式_______________________________。
(3)写出用KSCN鉴别G溶液的现象_________;向G溶液加入A的有关离子反应方程式_________________________________________。