等物质的量的下列化合物在相应条件下完全分解后得到氧气最多的是()
| A. |
|
B. |
|
| C. |
|
D. |
|
下列现象或事实解释正确的是
| A.铁制容器可盛装冷的浓硫酸,因为常温下铁和浓硫酸不反应 |
| B.铝热反应提供一定的能量引发,因为铝热反应为吸热反应 |
| C.增加炼铁高炉(右图)的高度并不能提高CO的转化率,因为化学平衡没有移动 |
| D.鸡蛋清中加入2滴1%醋酸铅溶液后产生沉淀,因为蛋白质发生了盐析 |
下列描述错误的是
| A.单质硅可用于制造光纤和太阳能电池 |
| B.将氯气通入冷的消石灰可制得漂白粉 |
| C.右图所示的三种物质间的相互转化均可一步实现 |
| D.Na2CO3饱和溶液中持续通入CO2气体有固体析出 |
粉煤灰是燃煤电厂排出的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为43.4%,还有含量较多的SiO2(其他成分不含Al和Si)。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式为:
Al6Si2O13 + 3Na2CO3 → 2NaAlSiO4+ 4NaAlO2 + 3CO2↑ ①
Al6Si2O13 + 5Na2CO3→ 2Na2SiO3 + 6NaAlO2 + 5CO2↑ ②
SiO2 + Na2CO3→ Na2SiO3 + CO2↑ ③
(1)粉煤灰中铝的质量分数为 % 。
(2)用1 mol Al6Si2O13 和 4 mol SiO2制得5mol NaAlO2、1mol NaAlSiO4,还应制得Na2SiO3____________mol,共消耗Na2CO3 mol(得到的固体中无SiO2)。
(3)若粉煤灰中 Al6Si2O13 与 SiO2的物质的量之比为1:2,则1kg粉煤灰与6mol Na2CO3反应(反应物全部都参与反应),可制得NaAlO2_________________mol。
(4)若用100 mol Al6Si2O13同时生产NaAlSiO4和NaAlO2,且n(NaAlSiO4):n(NaAlO2) = x,消耗Na2CO3 y mol,试确定y与x的关系式。
甲、乙两烧杯中分别盛有10mL 1mol·L-1AlCl3溶液,在甲烧杯中加入一定量NaOH溶液;乙烧杯中加入与上述NaOH溶液等体积、等pH的氨水。下列有关两个烧杯的说法中,正确的是 ( )
| A.甲中产生的沉淀一定比乙中多 |
| B.乙中产生的沉淀一定比甲中多 |
| C.甲和乙产生的沉淀一定一样多 |
| D.甲和乙中产生的沉淀可能一样多 |
下列有关元素化合物的叙述中正确的是 ( )
| A.碱金属原子的最外层电子数都是1,次外层电子数都是8 |
| B.将SO2通入滴有紫色石蕊试液的水中,溶液变成红色 |
| C.白磷易溶于水,不能保存在水中 |
| D.高性能通信材料光导纤维的主要原料是单品硅 |
在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,酸G是重要的化工产品和化工原料;固体H能溶解在A溶液和酸G中,且H为良好的耐火材料(图中部分产物没有列出)。
(1)写出M和过量的固体甲反应的化学方程式:
(2)如图表示的是生产酸G的工业流程:
①设备乙的名称为 ;
②气体X的主要成分为 ;
③写出设备甲中常见的化学反应 ;
(3)固体乙与M反应的化学方程式为 。
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业制备无水AlCl3的流程如下: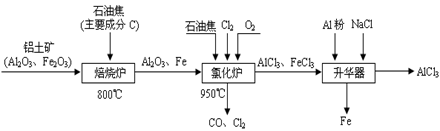
(1)已知:C(s)+O2(g)=CO(g);△H=-110.5kJ·mol-1 ①
2Fe(s)+O2(g)=Fe2O3(s) ;△H=-822.1kJ·mol-1 ②
请写出C还原Fe2O3生成CO的热化学方程式:
。
(2)氯化炉中通入O2的目的是 。
(3)氯化炉中Al2O3、C12和C反应的化学方程式是 。
(4)氯化炉中导出的气体,通常用亚硫酸钠溶液来吸收,请写出用Na2SO3溶液处理尾气时发生反应的离子方程式 。
(5)在升华器中加入铝粉的目的是 。
仔细阅读下图,已知B、D、E、F、G是氧化物,F、K是氢化物;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)。
请按要求回答:
(1)反应①既是分解反应,又是氧化还原反应,产物B、D、E、F的物质的量之比1:1:1:14。A强热分解的化学反应方程式为 。
(2)写出反应②在工业生产上的一种用途: 。
(3)反应③的离子方程式为 ;
反应④的化学方程式为 。
(4)常以C或H制成容器盛装和运输I的浓溶液,其原理是
。
反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4==2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3==2Na2SO4+3NaHSO4+H2O+I2
下列有关说法正确的是
| A.NaI和NaIO3在一定条件下能反应生成I2 |
| B.I2在反应①中是还原产物,在反应②中是氧化产物 |
| C.两个反应中生成等量的I2时转移的电子数相等 |
D.氧化性:MnO2>IO >I2>SO >I2>SO >Mn2+ >Mn2+ |
 有关物质存在如图所示的转化关系(部分产物已省略)。通常
有关物质存在如图所示的转化关系(部分产物已省略)。通常为气体单质,
为紫黑色固体单质。实验室中,常用固体
在
的催化下加热制取气体单质
。




 请回答下列问题:
请回答下列问题:
 (1)反应①的化学方程式为
(1)反应①的化学方程式为
 (2)反应②的离子方程式为
(2)反应②的离子方程式为
(3)写出另外一种实验室制取的化学方程式
 (4)
(4)溶液与
溶液混合可形成沉淀,此沉淀的
=7.0×10-9。将等体积的
溶液与
溶液混合,若
的浓度为1×10-2
,则生成沉淀所需
溶液的最小浓度为。