已知A、B、C、D、E、F六种短周期元素中,A、B、C、D是组成蛋白质的基本元素;A与B的原子序数之和等于C原子核内的质子数;A与E、D与F分别位于同一主族,且F原子核内的质子数是D原子核外电子数的2倍。据此,请回答:
(1)F在周期表中的位置是 。
(2)由A、C、D、F按8:2:4:1原子个数比组成的化合物甲中含有的化学键类型为 ;甲溶液中各离子浓度由大到小的顺序为 (用离子浓度符号表示)。
(3)化合物乙由A、C组成且相对分子质量为32;化合物丙由A、D组成且分子内电子总数与乙分子内电子总数相等;乙与丙的反应可用于火箭发射(反应产物不污染大气),则该反应的化学方程式为 。
(4)由A、D、E、F组成的化合物丁能与硫酸反应并放出刺激性气味的气体,则丁的化学式为 ;实验测得丁溶液显弱酸性,由此你能得出的结论是 。
(5)由B、A按1:4原子个数比组成的化合物戊与D的常见气态单质及NaOH溶液构成原电池(如图),试分析:
①闭合K,写出左池X电极的反应式 ;
②闭合K,当X电极消耗1.6g化合物戊时(假设过程中无任何损失),则右池两极共放出气体在标准状况下的体积为 升。
某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
| 熔点/℃ |
660 |
2054 |
1535 |
1462 |
| 沸点/℃ |
2467 |
2980 |
2750 |
- |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是______________,反应的离子方程式为_________________________________。
(3)实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。 试回答下列问题:
试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为________________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式_______________ ;
上述现象说明溶液中_________________结合OH-的能力比_______强(填离子符号)。
(3) B与A的差值为_________mol。B点对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为___________mL
(16分)已知X、Y、Z、M、G、Q是六种短周期元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z的气态氢化物能与其最高价氧化物的水化物反应,G是地壳中含量最高的金属元素。
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号) 。
(2)Z在元素周期表中的位置为 。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) 。
(4)常温下,不能与G的单质发生反应的是(填序号) 。
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(5)已知化合物C含有下述元素中的某一种元素

①若D是一种强酸,则C与水反应的化学方程式为 。
有人认为“浓H2SO4可以干燥气体C”,某同学为了验证该观点是否正确,用如图装置进行实验.分液漏斗中应加入 ,打开分液漏斗进行实验,过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的解释和结论是 。

②若D是一种常见的强碱,则C与水反应的离子方程式为 。
某硅铁矿中主要含Si02、Fe304、Al203、Cu0。某工厂用它为原料进行综合应用来制取硅胶、铁红、铝、胆矾晶体,设计如下工业流程图:
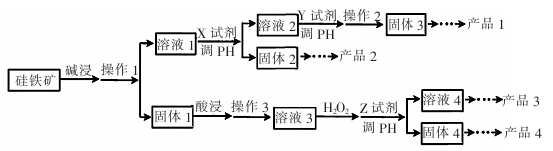
已知:Fe(OH)2、Fe(OH)3、Cu(OH)2完全沉淀的PH分别为9.6、3.7、9.4。
(1)碱浸时发生的离子反应方程式为:_
(2)为提高碱浸的浸出率,可采取的方法有 。(填两种即可)
(3)溶液3中加H2O2的目的是 。 对应的离子反应方程式为:________。
(4)Z试剂可以选用下列的 (填字母)
a. Cu b.CuO c.Cu(OH)2 d.CuCO3
(5)由溶液4制取产品3还要先加热到____(填字母)时,停止加热、冷却结晶。
| A.沸腾 |
| B.液体表面出现晶膜 |
| C.析出大量晶体 |
| D.快蒸干,还有少量液体 |
(6)判断固体4对应的元素沉淀完全的方法是:________________。
下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。请按要求填空:

(1)写出B的电子式:____________________。
(2)反应⑤的现象是_____________________________________________。
(3)反应①的化学反应方程式是______________________________________,
在实验室引发反应④的操作是____________________________________。
(4)反应⑥的离子方程式是_________________________________________。
以食盐为原料进行生产并综合利用的某些过程如下图所示。
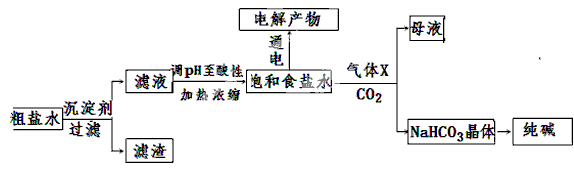
(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填字母) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 。
(3)电解饱和食盐水可得到H2和另外两种产物,这两种物质相互反应的离子方程式为 ,欲从饱和食盐水中获得食盐晶体,可采用的实验方法是 。
(4)气体X可增大饱和食盐水吸收CO2的量,有利于NaHCO3晶体的生成和析出,X的化学式是 。
(5)下列有关NaHCO3和纯碱的说法正确的是 (填字母)
| A.NaHCO3属于盐类,纯碱属于碱 |
| B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率相同 |
| C.常温下在水中的溶解度,NaHCO3大于纯碱 |
| D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2 |
根据表中左栏信息,回答右栏有关问题:
| 信 息 |
问 题 |
| ①短周期元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数均不少于最内层电子数。其中X是形成化合物种类最多的元素。 |
(1)X元素的最高价氧化物的电子式是 |
| ②在一定条件下,上述四种元素的单质均能与足量的氧气反应,其中Z元素的氧化物既能溶于稀硫酸,又能溶于浓NaOH溶液。 |
(2)Z元素在元素周期表中位于第_____周期,_____族。 |
| ③Y固体单质与盐酸反应,再向反应后的溶液中加入过量的烧碱溶液,最终溶液中有白色沉淀生成。 |
(3)写出生成白色沉淀的化学方程式 。 |
| ④向上述四种元素的单质的混合物中加入足量的烧碱,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中有白色沉淀。 |
(4)最终生成白色沉淀的离子方程式为 。 |
| ⑤X、Y、Z、W四种元素的原子半径由大到小的顺序为____________(用元素符号表示) |
A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。
请回答下列问题:
(1)D的化学式为 。
(2)写出实验室制Y的化学方程式 。
(3)反应③的离子方程式为 。
(4)写出反应①的化学方程式 。
(5)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为 。
(6)常温下0.1 mol·L-1的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度0.1 mol·L-1
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1 mol·L-1的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH为9
氢气还原氧化铜反应不完全时,得到的是Cu、Cu2O、CuO的固体混合物。某化学兴趣小组为了探究某次氢气还原CuO实验最终所得的产物的组成,进行了如下实验:
①取一定质量的均匀的上述固体混合物A,将其分成两等份。
②取其中一份用足量的氢气还原,测得反应后固体的质量减小了3.20g
③另一份加入500mL的稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体2.24L。
请回答以下问题:
(1)A中,所含氧元素的物质的量为_________。
(2)A中,n(Cu)+n(Cu2O)=_______________。
(3)所用稀硝酸的物质的量浓度为_______________。
C、N、O、Al、Si、Cl、Fe是七种常见元素
(1)N元素位于周期表第 周期,第 族,C元素的一种同位素可测定文物年代,这种同位素的符号是 。
(2)用“>”、“<”或“= ”填空:
| 离子半径 |
得电子能力 |
酸性 |
金属性 |
| O2― Al3+ |
16O 18O |
H2CO3 HNO3 |
Fe Al |
(3)SiO2及硅酸盐在自然界广泛存在,在日常生活、生产、科研及新型材料等方面有着重要的用途。高岭土[Al2(Si2O5)(OH)4]改写成氧化物的形式为 。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目 。
(5)将铝片(表面除去氧化膜)与碳棒用导线连接后插入稀NaOH溶液中可以构成原电池,电池正极为 ,电池负极反应的电极方程式为 。
目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等。某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:

(1)操作X所需要的主要玻璃仪器为 ;反萃取时加入20%的NaOH溶液,其离子方程式为 。
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是: 。
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出。与传统工艺相比,萃取法的优点是 。
(4)已知在酸性条件下溴酸盐可发生如下离子反应:
Ⅰ.2BrO+10Cl-+12H+===5Cl2↑+Br2+6H2O;Ⅱ.6BrO+5Cl-+6H+===5ClO+3Br2+3H2O,现将120 mL 0.4 mol·L-1KBrO3溶液和100 mL 0.6 mol·L-1KCl溶液在稀H2SO4中混合,充分反应后,产物KClO3和Cl2的物质的量之比为________。
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+。当加入一种淡黄色固体并加热溶液时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示。

(1)写出反应②和④的离子方程式
② 。
④ 。
(2)溶液中含有的离子是 ,它们的物质的量浓度之比为 。
第63届联合国大会通过决议,将2011年定为“国际化学年”,其主题是“化学——我们的生活,我们的未来”,以纪念化学学科所取得的成就及对人类文明的贡献。请回答下列问题:
(1)工业上生产玻璃、水泥都要用到的原料是 。
(2)工业上将氯气通入石灰乳制取漂白粉,漂白粉的有效成分是(填化学式) 。
(3)酸雨有很大的危害,能直接破坏农作物,使土壤酸化。形成酸雨的原因之一是燃煤中产生了气体(填化学式) 。
(4)过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源,写出过氧化钠与二氧化碳的化学反应方程式 。
(5)小苏打、氢氧化铝、三硅酸镁等可治疗胃酸过多,写出胃舒平(主要成分为氢氧化铝)与胃酸(主要成分为稀盐酸)作用的离子方程式 。
A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如下图所示:
请回答下列问题:
(1)若A为金属单质,B为非金属氧化物,则该反应的化学方程式为 ;请写出质量数为26的A的一种核素符号 。
(2)若A为非金属单质,B为非金属氧化物,且A、X为同主族元素,则该反应的化学方程式为 。
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
图G52
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的2个用途:__________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:__________________________________。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:__________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式:____________________。D的化学式是______。
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:_______________________________。