I实验室用加热固体氯化铵和氢氧化钙的混合物制取氨,反应的化学方程式为: 。所制得气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出适当选择,并将编号字母填入表中的空格处。
(1)装置:
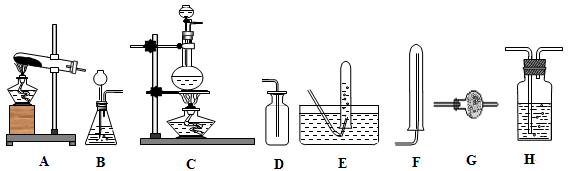
(2)试剂: a.NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液 e.碱石灰f.品红溶液 g.湿润的红色石蕊试纸
| 制取 气体 |
杂质气体 |
制取气体的 发生装置 |
除去杂质气体的净化装置 |
收集 装置 |
净化装置内 所用试剂 |
检验制得气 体所用试剂 |
| NH3 |
H2O(g) |
|
|
|
|
|
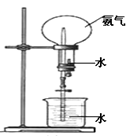
II如图所示,在干燥的圆底烧瓶里充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。立即倒置烧瓶,使玻璃管插入盛有水的烧杯里(预先在水里滴入少量酚酞溶液)。打开橡皮管上的夹子,轻轻挤压滴管,使少量水进入烧瓶,可观察到的现象为:____ 。
下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图所示),一定没有沉淀生成的是( )
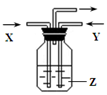
| |
X |
Y |
Z |
| A |
NO2[k.Com] |
HCl |
AgNO3 |
| B |
NH3 |
O2 |
Al2(SO4)3 |
| C |
CO2 |
SO2 |
CaCl2 |
| D |
NH3 |
CO2 |
CaCl2 |
下图为含有同一种元素的a、b、c、d、e五种物质的转化关系。其中a是单质,b是气态氢化物,c、d是氧化物,e是该元素最高价氧化物对应的水化物,
则a可能是( )
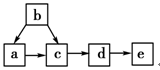
①C ②N2 ③S ④F2
| A.只有①和③ | B.只有④ | C.①②③ | D.①②③④ |
下列反应起到了氮的固定作用的是( )
| A.N2和H2在一定条件下反应生成NH3 |
| B.NO和O2反应生成NO2 |
| C.NH3经催化氧化生成NO |
| D.由NH3制碳铵(碳酸氢铵)和硫铵(硫酸铵) |
下列关于硝酸和硫酸的叙述中,错误的是( )
| A.浓硝酸和浓硫酸都具有很强的腐蚀性、脱水性 |
| B.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 |
| C.稀硫酸和稀硝酸都具有氧化性 |
| D.硫酸和硝酸都是重要的化工原料 |
在NO2与水的反应中( )
| A.氮元素的化合价不发生变化 | B.NO2只是氧化剂 |
| C.NO2只是还原剂 | D.NO2既是氧化剂,又是还原剂 |
氮及其化合物之间可以互相转化,请按照要求回答下列问题:
(1)实验室制取氨气。
① 实验室制取氨气的反应原理是利用了 类物质与 类物质的反应。
② 可用向下排空气法收集氨气的原因是 。
③ 用水吸收多余的氨气时,如将导管直接插入水中, 会产生倒吸现象,产生该现象的原因是 。
(2)完成下列能生成NO的化学方程式:
① 体现N元素的还原性:氨的催化氧化:____________。
② 体现N元素的氧化性:____________。
下列气体为红棕色的是
| A.NO2 | B.NO | C.SO2 | D.N2 |
某学习小组为研究铜与浓、稀HNO3反应的差异,设计了如图所示的实验装置。

实验步骤如下:
Ⅰ.检查装置的气密性;
Ⅱ.向装置A中通入过量的CO2气体,关闭弹簧夹;
Ⅲ.滴加浓硝酸;
……
(1)步骤Ⅲ中滴加浓硝酸的具体操作是 。
(2)A装置中反应的化学方程式是 。
(3)B中溶液慢慢变成蓝色,能解释此现象的化学方程式是 。
(4)证明B中有NO生成的实验操作是 。
(5)步骤Ⅱ向装置A中通入过量CO2气体的目的是 。
(6)上述实验结束后,观察到A装置中的溶液呈绿色,B装置中的溶液呈蓝色。在分析溶液为绿色的原因时,甲同学用加水稀释的方法,乙同学认为不合理,因在稀释时,也会引起Cu2+浓度变化。请设计实验证明绿色是由溶有NO2引起的 。
实验室用下图所示装置进行氨气实验。

(1)试管中发生反应的化学方程式是_________________。
(2)干燥管中盛放的干燥剂是_______________(填名称)。
(3)请在方框中画出收集一烧瓶氨气的装置。
(4)检验氨气是否收集满,可选用_________试纸,实验现象是_______________。
(5)用右图装置做喷泉实验。轻轻挤压滴管,使少量水进入烧瓶,打开止水夹,观察到的现象是 ,出现这一现象的原因是 。
某厂每天产生800m3含氮的废水(NH3的含量为168mg∙L-1)。该厂处理废水的方法是:将废水加热得到NH3,使废水中NH3的含量降为15mg∙L-1(假设废水处理前后体积不变)。再对加热蒸发得到的NH3进一步处理制取硝酸。
(1)制取硝酸过程中主要发生反应如下:①_________________,②4NO+3O2+2H2O=4HNO3。反应①是氨气在一定条件下被氧气氧化,请在横线上写出该反应的化学方程式。
(2)该厂每天通过加热蒸发可得到NH3的物质的量是__________________。
(3)若在反应①中N元素损失10%,则该厂每天可生产硝酸多少吨?(写出计算过程,结果保留2位小数)
下列有关硫酸和硝酸的叙述正确的是( )
| A.将浓硫酸和浓硝酸分别长期露置在空气中,浓度均会降低 |
| B.在常温下,浓硫酸和浓硝酸均能与铜剧烈反应 |
| C.稀硫酸和稀硝酸分别与金属反应时,S和N的化合物都会发生变化 |
| D.因为浓硫酸和浓硝酸都能与铁反应,所以常温下二者都不能用铁剂容器盛装 |
下列气体的实验室制法正确的是( )
| A.Cl2:电解饱和食盐水 | B.O2:过氧化氢与二氧化锰混合 |
| C.H2:锌粒和稀硝酸混合 | D.NH3:氮气和氢气混合 |
常温下,下列气体为无色的是( )
| A.NO2 | B.ClO2 | C.Cl2 | D.SO2 |