合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
(1)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应),当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 (填“变大”、“变小”或“不变”) 。
2NH3(g)(正反应为放热反应),当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 (填“变大”、“变小”或“不变”) 。
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: _________________。
(3)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是________。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若a mol CO和H2的混合气体(H2的体积分数为80%)与H2O反应,得到1.14a mol CO、CO2和H2的混合气体,则CO转化率为__________________。
上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)______。
简述本流程中提高合成氨原料总转化率的方法: 。
(1)联氨(N2H4)是一种高能燃料。工业上可以利用氮气和氢气制备联氨。
已知:N2(g)+2H2(g)=N2H4(l) △H=" +" 50.6kJ·mol-1; 2H2(g)+O2(g)=2H2O(l) △H="-571.6" kJ·mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l) △H= kJ·mol-1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 。
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 。
(2)在纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,则N2H4发生分解反应的化学方程式为 。
(3)N2H4与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的相对分子质量为43.0,其中氮原子的质量分数为0.977。该氢化物受撞击后可完全分解为两种单质气体。该氢化物分解的化学方程式为 。
(4)氨氧化法制硝酸工业尾气中的NO、NO2气体可用氨水吸收,反应方程式为6NO+4NH3===5N2十6H2O,6NO2+8NH3===7N2+12H2O。若尾气中NO和NO2共18 mol被氨水完全吸收后,产生了15.6 mol N2,则此尾气中NO与NO2的体积比为 。
工业制硝酸经以下一系列反应: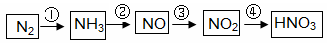
请回答:
(1)写出反应④的化学方程式 ,实验室收集NO的方法是 。
(2)对于氮的化合物,下列说法不正确的是(选填序号字母) 。
a.氨可用作制冷剂
b.铵态氮肥一般不能与碱性化肥共同使用
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol NO2
(3)已知:H2(g)+1/2 O2(g)=H2O(g) △H1=-241.8kJ/mol
N2(g)+ 3H2(g)=2NH3(g) △H2=-92.0kJ/mol
则34g氨气与氧气反应生成N2(g)与H2O(g)时,△H= kJ/mol。
(4)氨气在微生物的作用下与氧气反应生成HNO2,写出该反应的化学方程式 。
(5)氨气是氮肥工业的重要原料,某化肥厂生产铵态氮肥(NH4)2SO4的部分工艺流程如下: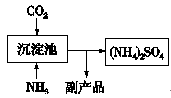
向装有CaSO4悬浊液的沉淀池中先通氨气,再通CO2的原因(请从溶解度和溶解平衡角度分析) 。
(14分)氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)某课外学习小组欲制备少量NO气体,写出铁粉与足量稀硝酸反应制备NO的离子方程式: 。
(2)LiFePO4是一种新型动力锂电池的电极材料。
①下图为某LiFePO4电池充、放电时正极局部放大示意图,写出该电池放电时正极反应方程式: 。

②将LiOH、FePO4·2H2O(米白色固体)与还原剂葡萄糖按一定计量数混合,在N2中高温焙烧可制得锂电池正极材料LiFePO4。焙烧过程中N2的作用是 ;实验室中以Fe3+为原料制得的FePO4·2H2O有时显红褐色,FePO4·2H2O中混有的杂质可能为 。
(3)磷及部分重要化合物的相互转化如图所示。

①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是 。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1molCuSO4所能氧化的白磷的物质的量为 。
③步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有 。
氮元素是地球大气中含量最多的元素。
(1)氮元素和碳元素一样也存在一系列氢化物并有广泛应用。例如:NH3、N2H4、N3H5、N4H6……。
①写出该系列氢化物的通式: 。
②N4H5Cl的同分异构体有 种。
(2)NH3、OH-、H2O结合质子(H+)的能力由强到弱的顺序是 ,其理由用两个反应的离子方程式表示为NH4++OH-= NH3+H2O和 。
(3)在碱性介质中,用N2H4与NO2可组合制成燃料电池,产物中无污染物,试写出该电池正极的电极反应式 。
(4)①CaCO3和适量稀HNO3溶液反应时,每产生4.4g气体(不考虑气体溶解),放热a kJ,则该反应的热化学方程式为___________________。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示。
请用离子方程式表示B-C段发生的反应: 。
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:
【查阅资料】金属活泼性不同,其硝酸盐分解产物不同
(1)K→Na活泼金属的硝酸盐分解生成亚硝酸盐和氧气;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2;
(3)Hg以后不活泼金属的硝酸盐分解生成金属、NO2和O2。
2KNO3 2KNO2↑+O2↑ 2Cu(NO3)2
2KNO2↑+O2↑ 2Cu(NO3)2 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
I:【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态。该小组甲同学将其溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。①向一份溶液中滴入少量KSCN溶液;②少量稀酸性KMnO4溶液中滴入另一份溶液。现象:①溶液变红色;②溶液变红色。
(1)则Fe(NO3)2分解的化学方程式是 。
II:【实验二】探究Fe(NO3)2热分解气体产物的性质。小组乙、丙同学进行了如下图所示的实验(收集时操作恰当,几乎没有空气)
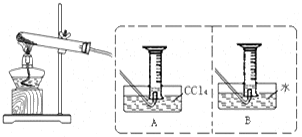
实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管,并重新连接好仪器;④加热;⑤……
(2)乙同学使用A装置收集气体,恰好收集到54mL红棕色气体,要从水槽中取出量筒,乙同学的正确操作方法是 。
(3)丙同学取等质量Fe(NO3)2的在同样条件下热分解,用B装置收集气体产物,可收集到气体_____mL。
III:【实验三】探究固体混合物的组成和特征
(4)小组丁同学取KNO3、 Cu(NO3)2、 Fe(NO3)2混合粉末充分加热后用排水法未收集到任何气体,则KNO3、Cu(NO3)2、 Fe(NO3)2物质的量之比可能为____________。
| A.1∶2∶2 | B.2∶1∶3 | C.1∶2∶3 | D.3∶8∶5 |
(5)取0.6mol由KNO3、 Cu(NO3)2、 Fe(NO3)3按等物质的量之比混合而成的粉末溶于100mL 3mol/L的稀硫酸中,再向溶液中加入足量的铜粉,则最多可溶解铜粉质量为_________
氨气是一种重要的化工产品,工业上可以按照下图所示流程生产氨气:

(1)原料气之一氮气的工业制取方法是 ,写出氨气的工业用途(任答一点) 。
(2)写出合成塔中发生的反应的化学反应方程式 。在冷却塔中对混合气体进行冷却,冷水的入口 (答m或n)。
(3)设备C的作用 。其分离器中的过程对整个工业合成氨的意义 (试结合平衡移动原理回答)。
(4)在原料气制备过程中混有 CO对催化剂有毒害作用,欲除去原料气中的 CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过80%,则起始物中c(H2O):c(CO)不低于 (精确到小数点后一位)。
CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过80%,则起始物中c(H2O):c(CO)不低于 (精确到小数点后一位)。
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
写出由磷酸钙矿制取白磷总的反应方程式____________。
(2)白磷在热的浓氢氧化钾溶液中歧化得到一种次磷酸盐(KH2PO2)和一种气体 (写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在 之间(已知磷酸的各级电离常数为:K1 = 7.1×10−3 K2 = 6.3×10−8 K3 =4.2×10−13 lg7.1≈0.9 lg6.3≈0.8 lg4.2≈0.6) 。Na2HPO4溶液显碱性,若向其溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是 (用离子方程式表示)。
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O= 20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是 。
为了证明稀硝酸与铜反应的气体产物是NO,某同学设计了如下实验装置和实验方案。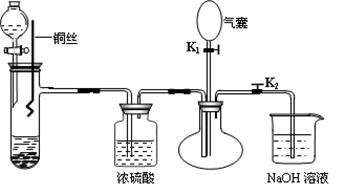
实验步骤:
(1)关闭K1,打开K2,向试管中加石灰石,通过分液漏斗向其中加入一定的稀硝酸,则加入石灰石的作用是________________________________,反应化学方程式是 。
(2)将将铜丝插入稀硝酸中,微热大试管。该步反应离子方程式是 。
(3)充分反应后,打开开关K1,通过气囊鼓入空气,可以观察到烧瓶中 ,证明稀硝酸与铜反应的气体产物是NO。
(4)NaOH溶液的作用 。
(6分)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体,在标准状况下的体积为11.2 L。
计算:(1)产生的NO、 NO2体积各为多少升?
(2)待气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶
液中的Cu2+全部转化为沉淀,则原硝酸溶液的浓度为多少?
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入6 mol·L—1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.60 mL | B.50 mL | C.30 mL | D.15 mL |
合成氨反应是化学上最重要的反应:
(1)合成氨原料气中的氢气可利用天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应制得,反应中每生成2 mol CO2吸收316kJ热量,该反应的热化学方程式是_______________________,该方法制得的原料气中主要杂质是CO2,若用K2CO3溶液吸收,该反应的离子方程式是________________。
(2)已知N2(g)+3H2(g) 2NH3(g) ΔH<0。下图是当反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
2NH3(g) ΔH<0。下图是当反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

①曲线a对应的温度是________。
②关于工业合成氨的反应,下列叙述正确的是________(填序号)
| A.上图中M、N、Q点平衡常数K的大小关系为K(M)=K(Q) >K(N) |
| B.加催化剂能加快反应速率但H2的平衡转化率不变 |
| C.相同压强下,投料相同,达到平衡消耗时间关系为c>b>a |
| D.由曲线a可知,当压强增加到100 MPa以上,NH3的物质的量分数可达到100% |
③N点时c(NH3)=0.2 mol·L-1,N点的化学平衡常数K=_________________(精确到小数点后两位)。
(3)合成氨工业中含氨废水的处理方法之一是电化学氧化法,将含氨的碱性废水通入电解系统后,在阳极上氨被氧化成氮气而脱除,阳极的电极反应式为______________________。
(4)NH3可以处理NO2的污染,方程式如下: NO2+ NH3 N2+ H2O(未配平)当转移0.6 mol电子时,消耗的NO2在标准状况下是 L。
N2+ H2O(未配平)当转移0.6 mol电子时,消耗的NO2在标准状况下是 L。
硝酸与合成氨工业密切相关,氨氧化法是工业生产中制取硝酸的主要途径。
完成下列计算:
52.合成氨时,假设100L的氮气与氢气(体积比为1 : 3)的混合气体通过氨合成塔充分反应后,体积变为90L,则氮气的转化率为 。(写出计算过程,计算结果请用百分数表示)
53.标准状况下,将500L氨气溶于1L水中形成氨水,则此氨水质量分数为 。(写出计算过程,计算结果请用百分数表示,并保留1位小数)
54.氨氧化法是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮(NO)。此时温度很高,水以水蒸气的形式存在,NO也不与O2反应。若氨气与氧气物质的量之比为1:1.7时,氨的转化率可达95%,计算反应后NO的体积分数 。(设氧气在空气中的体积分数为20%,写出计算过程,计算结果请用百分数表示并保留1位小数)
55.一氧化氮继续氧化为二氧化氮,二氧化氮溶于水可得硝酸。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。( 已知金不溶于浓硝酸)
填写该18K金的成分表(写出计算过程,计算结果请用百分数表示并保留1位小数,若不含该金属则填0)。
| 18K金成分 |
Au |
Ag |
Cu |
| 含量(质量分数) |
75 % |
_________ |
_________ |
H2还原CuO所得的红色固体可能是Cu与Cu2O的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。现有8g CuO被H2还原后,得到红色固体6.8g。
(1)6.8 g上述混合物中含Cu与Cu2O的物质的量之比是 ;
(2)若将6.8 g上述混合物与足量的稀硫酸充分反应后过滤,可得到固体 g;
(3)若将6.8 g上述混合物与一定量的浓硝酸充分反应,生成标准状况下1.568 L的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分及物质的量之比是 ;