SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
(1)装置Ⅰ中生成HSO3-的离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。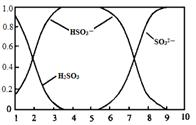
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。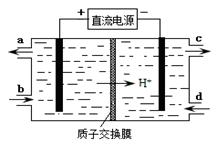
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L(用含a代数式表示,计算结果保留整数).
含氮化合物是重要的化工原料。存在如下转化关系:
(1)工业上常用浓氨水检验氯气管道是否泄漏。
①氨气溶于水的过程中存在的平衡有 (用离子方程式表示)。
②向固体氧化钙中滴加浓氨水,可用于实验室制取少量氨气,简述原理 。
(2)转化Ⅱ中发生的系列反应,在工业上可以用来制备硝酸,写出①中反应的化学方程式为 。
(3)现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱。转化Ⅲ中部分反应如下:
NH3+CO2+H2O  NH4HCO3,NH4HCO3+NaCl(饱和)
NH4HCO3,NH4HCO3+NaCl(饱和) NaHCO3↓+NH4Cl。
NaHCO3↓+NH4Cl。
①转化Ⅲ中有NaHCO3沉淀析出的原因是 。
②欲测定某工业纯碱样品中Na2CO3的质量分数,某同学设计方案如下:
准确称取10.00g样品,加入过量的盐酸,充分反应,蒸干、冷却后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。样品中碳酸钠的质量分数为 。
(4)以氨作为燃料的固体氧化物(含有O2一)燃料电池,具有全固态结构、能量效率高、无污染等特点。工作原理如图所示:
①固体氧化物作为电池工作的电解质,O2一移向 (填字母)。
A.电极a B.电极b
②该电池工作时,电极a上发生的电极反应为 。
下图是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图。请认真读图分析,回答有关问题。
(1)下列叙述中正确的是(填序号) 。
| A.图中横坐标是硝酸的密度,硝酸的密度越大,其浓度越小。 |
| B.当还原剂和温度相同时,不同浓度的硝酸被还原的产物不是单一的,只是在某浓度时,以某种产物为主而已。 |
| C.硝酸的浓度越大,还原产物中N元素低化合价产物越少。 |
| D.当硝酸密度大于1.3 g·cm-3时,还原产物主要为NO、NO2 |
(2)当硝酸溶液的密度为1.36 g·cm-3时,Fe与过量硝酸反应的化学方程式是_________________。
(3)限用下列仪器、药品验证由铁和过量1.36 g·cm-3硝酸反应产生的气体中含有NO(不考虑N2O4)。设计一个合理而简单的实验方案(仪器可选择使用,N2的用量可自由控制,加热装置和固定装置省略)。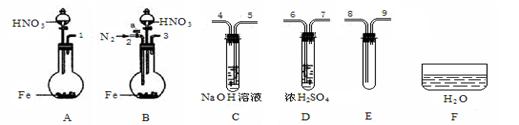
第1步:反应并收集生成的气体:
①实验中气体发生装置应选择 (填装置序号),理由是 。
②装置的连接顺序是(填各装置接口的序号):[ ]→[ ] [ ]→[8] [9]→[ ]。
③检查装置气密性后,开始反应。待E中充满红棕色气体,停止实验。
第2步:验证E中有NO。
④取下试管E,倒立在F中,轻轻摇动试管。
确认生成的气体中有NO的现象是 。
(4)某工厂生产硝酸的流程简要表示如下:
①氧化炉中反应的化学方程式为_____________________________________________________。
②工业上通常用质量分数为15%的Na2CO3水溶液(密度1.16 g·mL-1)作为NOx吸收剂,它的物质的量浓度为_____________ mol·L-1(保留2位小数)。
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
(1)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应),当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 (填“变大”、“变小”或“不变”) 。
2NH3(g)(正反应为放热反应),当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 (填“变大”、“变小”或“不变”) 。
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: _________________。
(3)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是________。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若a mol CO和H2的混合气体(H2的体积分数为80%)与H2O反应,得到1.14a mol CO、CO2和H2的混合气体,则CO转化率为__________________。
上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)______。
简述本流程中提高合成氨原料总转化率的方法: 。
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
(1)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程式是: (两个);不采用铜跟浓硫酸反应来制取硫酸铜的原因是 (答两点)
(2)在一定体积的10 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9 mol。则浓硫酸的实际体积 (填“大于”、“等于”或“小于”)180 mL。
(3)若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为
(4)将8 g Fe2O3投入到150 mL某浓度的稀硫酸中,再投入7 g铁粉,充分反应后,收集到1.68 L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4 mol·L-1的NaOH溶液150 mL。则原硫酸的物质的量浓度为
铵盐是一种重要的水体污染物。某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理。
(1)电解法脱氮的原理可能如下:
①直接电氧化
在碱性条件下,发生2NH3 + 6OH- - 6e- = N2 + 6H2O反应的电极为 (填“阴”、“阳”)极;
②-OH(自由羟基)电氧化
在电流作用下,利用产生的强氧化性中间产物OH脱氮,-OH中O元素的化合价 ;
③间接电氧化
利用电解产生的Cl2,与H2O作用生成HClO进行脱氮。请写出HClO在酸性条件下氧化NH4+的离子方程式 。
(2)探究适宜的实验条件
下图为不同电流强度下脱氮的效果,综合考虑能耗因素,电流强度应选择 A。
(3)该课题组进一步探究脱氮过程中的强氧化性的活性中间产物,提出了如下假设,请你完成假设三:
假设一:只有·OH;
假设二:只有HClO;
假设三: 。
(4)请你设计实验探究脱氮过程中是否有·OH产生,完成下表内容。
| 实验方案 |
预期实验结果和结论 |
| 配制一定pH、NH4+和Cl-浓度的溶液,用最佳电流强度,电解样品90min后,采用电子自旋共振法检测样品中·OH |
|
(5)研究得知,脱氮过程主要以原理③为主,弱酸性溶液中比强酸溶液中更利于使NH4+转化为N2而脱氮,请从化学平衡移动的角度解释其原因 。
1902年德国化学家哈博研究出合成氨的方法,其反应原理为:
N2(g)+3H2(g) 2NH3(g);△H(△H<0)
2NH3(g);△H(△H<0)
一种工业合成氨的简易流程图如下:
完成下列填空:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生。NH4HS的电子式是___________,写出再生反应的化学方程式:__________________。NH3的沸点高于H2S,是因为NH3分子之间存在着一种比_________力更强的作用力。
(2)室温下,0.1 mol/L的氯化铵溶液和0.1 mol/L的硫酸氢铵溶液,酸性更强的是_______,其原因是___________________________________________________________。
已知:H2SO4:H2SO4 = H++HSO4-;
HSO4- H++SO42- :
H++SO42- :
K =1.2×10-2 NH3·H2O:K=1.8×10-5
(3)图甲表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:______(保留3位有效数字)。
(4)依据温度对合成氨反应的影响,在图乙坐标系中,画出一定条件下的密闭容器内,从常温下通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。
简述本流程中提高合成氨原料总转化率的方法(只答一种即可):_________________。
(本题14分)
烟气中NOx是NO和NO2的混合物(不含N2O4)。
(1).根据废气排放标准,1m3烟气最高允许含400mgNOx。若NOx中NO质量分数为0.85,则lm3烟气中最高允许含NO L(标准状况,保留2位小数)。
(2).若用氨气除去废气中的氮氧化物(NOx):NOx+NH3→N2+H2O(l)。假如每升废气中含NOx 0.0672L(只含NO和NO2),向100.000L废气中通入10.000L氨气可使NOx完全转化,测得反应后气体体积变为103.952L(气体体积均折算到标准状况)。
①NOx 中的 x 值为_________(保留1位小数)。
②除去废气中的NOx,至少需氨________mol(保留2位小数)。
(3).工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度l.16g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为 mol/L(保留2位小数)。
(4).已知:NO+NO2+Na2CO3 → 2NaNO2+CO2 ①
2NO2+Na2CO3 → NaNO2+NaNO3+CO2 ②
1m3含2000mgNOx的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气 排放标准(填“符合”或“不符合”), 理由: 。
(5).加入硝酸可改变烟气中NO和NO2的比,反应为:NO+2HNO3 → 3NO2+H2O
当烟气中n(NO):n(NO2)=2:3时,吸收率最高。
lm3烟气含2000mgNOx,其中n(NO):n(NO2)=9:1。
计算:
①为了达到最高吸收率,1m3烟气需用硝酸的物质的量(保留3位小数)。
②1m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
(一) 尿素又称碳酰胺,是含氮量最高的氮肥,工业上利用二氧化碳和氨气在一定条件下合成尿素。其反应分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵)(l) △H1= -330.0 kJ·mol-1
H2NCOONH4(氨基甲酸铵)(l) △H1= -330.0 kJ·mol-1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2=" +" 226.3 kJ·mol-1
H2O(l)+H2NCONH2(l) △H2=" +" 226.3 kJ·mol-1
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 m3 密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= mol/(L·min)。
③当反应在一定条件下达到平衡,若在恒温、恒容下再充入一定量气体He,则CO(NH2)2(l)的质量_________(填“增加”、“减小”或“不变”)。
(二)氨是制备尿素的原料,NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
氨气溶于水得到氨水,在25℃下,将amol/L的氨水与bmol/L的硫酸以3∶2体积比混合反应后溶液呈中性。用含a和b的代数式表示出氨水的电离平衡常数为_________。
(三)氢气是合成氨的原料。“氢能”将是未来最理想的新能源。
(1)在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 。
(2)氢气通常用生产水煤气的方法制得。其中C(s)+ H2O(g) CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
①当加热到850℃反应达到平衡的标志有______________ 。
| A.容器内的压强不变 |
| B.消耗水蒸气的物质的量与生成CO的物质的量相等 |
| C.混合气的密度不变 |
| D.单位时间有n个H-O键断裂的同时有n个H-H键断裂 |
②x应满足的条件是 。
(四)CO2是合成尿素的原料,但水泥厂生产时却排放出大量的CO2。华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示: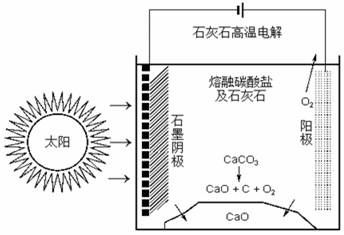
(1)上述生产过程的能量转化方式是 。
(2)上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为 ,阴极的电极反应式为 。
(16分)汽车尾气中CO、NOx 以及燃煤废弃中的SO2都是大气污染物,对它们的治理具有重要意义。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ中,NaOH溶液吸收SO2也可生成Na2SO3和NaHSO3的混合溶液
①写出NaOH溶液吸收SO2生成等物质的量的Na2SO3和NaHSO3混合溶液时总反应的离子方程式 。
②已知混合液pH随 :n(
:n( )变化关系如下表:
)变化关系如下表:
 |
91:9 |
1:1 |
9:91 |
 |
8.2 |
7.2 |
6.2 |
当混合液中 时,c(Na+) c(HSO3-)+ 2c(SO32-)(填“>”“=”或“<”)
时,c(Na+) c(HSO3-)+ 2c(SO32-)(填“>”“=”或“<”)
(2)装置Ⅱ中,酸性条件下,NO被Ce4+ 氧化的产物主要是NO3- 、NO2- ,写出只生成NO2-的离子方程式 ;
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。

①生成的Ce4+从电解槽的 (填字母序号)口流出;
②生成S2O42 - 的电极反应式为 ;
(4)已知进入装置Ⅳ的溶液中,NO2- 的浓度为a g·L- 1 ,要使1m3该溶液中的NO2- 完全转化为NO3-,至少需向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示)
氮元素的单质及化合物在工农业生产中有重要应用。
(1)①氮气用于工业合成氨,写出氮气的电子式 ;
②NH3的稳定性比PH3 (填写“强”或“弱”)。
(2)如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。
①浓盐酸液滴附近发生反应的化学方程式为 。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是 (写化学式,一种即可)。
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2+ + 2NH3·H2O= Fe(OH)2↓+ 2NH4+ 和 _______ 。
(3)将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3,则出现白色沉淀,请写出反应的离子方程式______________________________________;若将SO2气体通入酸化的硝酸钡溶液,也产生白色沉淀,用离子方程式加以说明 。
(4)氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物。首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。
已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3
写出氧化吸收法除去氮氧化物的化学方程式___________________。
(5)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为 _________ ,若反应中有3 mol电子发生转移时,生成亚硝酸的质量为 g。
向含有0.8 mol的稀硝酸中慢慢加入22.4 g的铁粉,假设反应分为两个阶段。
第一阶段为:Fe+HNO3(稀)→Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段发生反应的离子方程式:
第一阶段: 。
第二阶段: 。
(2)在图中画出溶液中Fe2+、Fe3+、NO3-的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量)。
工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:____________。
当温度降低时,化学平衡常数K值________(填“增大”、“减小”或“无影响”)。
(2)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是________(填字母)。
| A.容器内N2、H2、NH3的浓度之比为1∶3∶2 |
| B.v正(N2)=v逆(H2) |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.0 mol,n(H2)=0.8 mol,n(NH3)=0.8 mol,则反应速率v(H2)=________,平衡常数=________。
③若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度 (填“大于”、“小于”或“等于”)原来的2倍。
氯化亚铜(
)广泛应用于化工、印染、电镀等行业。
难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是
和少量
)为原料,采用硝酸铵氧化分解技术生产
的工艺过程如下: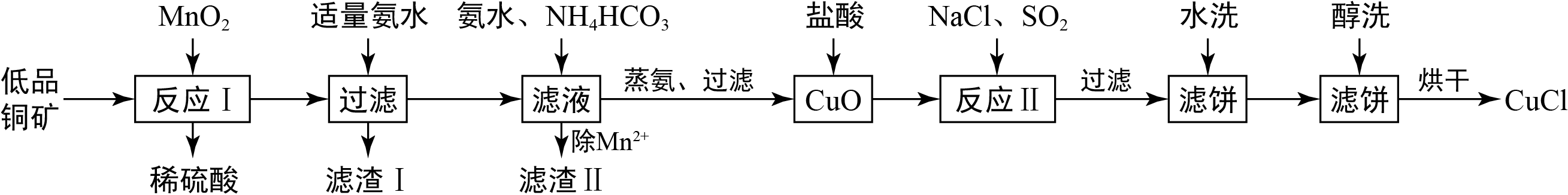
回答下列问题:
(1)步骤①中得到的氧化产物是,溶解温度应控制在60~70度,原因是。
(2)写出步骤③中主要反应的离子方程式。
(3)步骤⑤包括用
=2的酸洗、水洗两步操作,酸洗采用的酸是(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是 。
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有(填字母)
| A. | 分馏塔 | B. | 离心机 | C. | 反应釜 | D. | 框式压滤机 |
(6)准确称取所制备的氯化亚铜样品 ,将其置于若两的 溶液中,待样品完全溶解后,加入适量稀硫酸,用 的 溶液滴定到终点,消耗 溶液 ,反应中 被还原为 ,样品中 的质量分数为。
(8分) “低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
请回答下列问题:
(1)工艺操作②为:____________。
(2)工业合成氨的化学方程式为:____________________。
(3)副产品的化学式为_________。该联合生产工艺中可以循环使用的物质是_________________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________________。
(5)写出生成“产品”的化学方程式:_______________________