NH3和HNO3是重要的工业产品,下图是合成氨和氨氧化制硝酸的工艺流程。
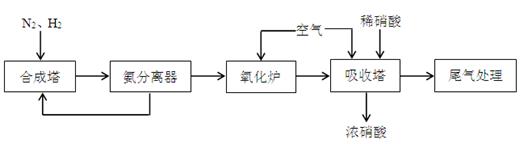
(1)合成塔中发生反应的化学方程式是 。
(2)氨分离器中压强约为15MPa,温度约为-20℃,分离氨应用了氨 的性质,从氨分离器中又回到合成塔中的物质是 。
(3)氧化炉中反生反应的化学方程式是 。
(4)尾气中的少量NO、NO2可以用NH3来处理,在催化剂作用下生成无污染的气体,写出NO2和NH3反应的化学方程式 。当有5.6LNO2被还原时,转移电子的物质的量为 mol。
(5)氧化炉中出来的气体,先降温再进入吸收塔,吸收塔中通入空气的作用是 。若进入吸收塔的气体的体积分数为NO210.0%,NO 1.32%,其余为N2、水蒸气等。当进入氧化炉中气体为10m3时,最少需要空气的体积为 m3。
某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置

请回答下列问题:
(1)装置F中发生反应的化学方程式为_________________________;
(2)B装置的名称是_____________________;
(3)E装置的作用_______________________;
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应 的化学方程式:___________________________;
(5)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?(用离子方程式表示)______________________________.
(6)实验室通常利用质量分数36.5%盐酸(密度为1.14g/mL)与二氧化锰通过反应制取Cl2。通过计算回答下列问题:(要求有计算过程)
①质量分数36.5%(密度为1.14g/mL)盐酸的物质的量浓度为多少?
②若要制取Cl2 2.24L(标准状况),理论上需要消耗MnO2多少克?
化学与环境密切相关.近年来雾霾问题已成为百姓所关注的主要问题,今年入秋以来,我国大部分地区更是“霾伏”四起,部分地区持续出现中度至重度霾,环境治理刻不容缓。回答下列问题:
(1)下列有关说法正确的是
A.光化学烟雾是氮氧化物与碳氢化合物受紫外线作用后产生的有毒烟雾
B.PH小于7的雨水都是酸雨
C.PM2.5含量的增加是形成雾霾天气的重要原因之一
D.大气中CO2含量的增加会导致臭氧空洞的加剧
(2)某化学实验小组测得某地区的雾霾中可能含有如下几种无机离子:Na+、NH4+、Mg2+、Al3+、SO42﹣、NO3﹣、Cl﹣.对该地区雾霾处理后获得试样溶液进行了如下的实验:
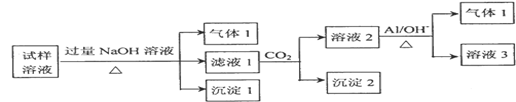
已知:3NO3﹣+8Al+5OH﹣+18H2O═3NH3↑+8[Al(OH)4]﹣
请回答下列问题:
①试样溶液加入过量NaOH溶液后生成沉淀Ⅰ的化学式是 .生成气体Ⅰ的离子方程式为 ,检验该气体的方法是 。
②根据实验结果,推测出雾霾中一定含有的离子有 ,若要确定原试样溶液存在的其它阴离子,可在试样溶液中先加入足量的 溶液,再取上层清液加入 溶液。
(3)若该实验小组测得另一地区雾霾试样中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、Cl﹣、NO3﹣中的几种.①若加入锌粒,排空法收集到无色无味气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间关系如图所示.则下列说法不正确的是

A.溶液中一定不含CO32﹣,可能含有SO42﹣和Cl﹣
B.溶液中n(Mg2+)=0.1mol
C.溶液中的阴离子的物质的量为0.35mol
D.n(H+):n(Al3+):n(Mg2+)=1:1:1
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素。
(1)若A为气体单质,则① B→E的化学方程式 ;
② 标准状况下,若将充满干燥D气体的烧瓶倒置于水槽中,烧瓶内液面逐渐上升,(不考虑烧瓶内溶液扩散因素),则最终烧瓶内所得溶液的物质的量浓度为
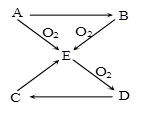
(2)若A为固体单质,且易溶于二硫化碳, 则 ① D的分子式 为 ;
② C→E的化学方程式为 ;
③ 将E通入某些单质的溶液中,可发生反应生成两种强酸,试举一例写出化学方程式 。
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
(1)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程式是: (两个);不采用铜跟浓硫酸反应来制取硫酸铜的原因是 (答两点)
(2)在一定体积的10 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9 mol。则浓硫酸的实际体积 (填“大于”、“等于”或“小于”)180 mL。
(3)若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为
(4)将8 g Fe2O3投入到150 mL某浓度的稀硫酸中,再投入7 g铁粉,充分反应后,收集到1.68 L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4 mol·L-1的NaOH溶液150 mL。则原硫酸的物质的量浓度为
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol·mol-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A.60mL | B.45mL | C.30mL | D.75mL |
现有铜、银合金14g与足量的某浓度的硝酸100mL发生反应,将生成的气体与1.12L(标况)氧气混合,通入足量的水中恰好全部吸收,反应后溶液体积仍为100mL。试通过计算回答下列问题:
(1)原固体混合物中铜和银的质量各是多少?
(2)若原硝酸溶液为浓硝酸,反应产生的气体是单一气体,则该反应中被还原的硝酸的物质的量是多少?
(3)合金完全溶解后,若生成的气体在标况下体积为2.24L,反应后溶液中c(H+)=7mol/L,则该混合气体中NO和NO2在标准状况下的体积分别是多少?原硝酸的浓度是多少?
A~H是纯净物或溶液中的溶质,其中A是日常生活中应用最广、用量最大的金属单质。它们之间有如下关系:(部分产物和反应条件略)

根据上述信息,回答下列问题:
(1)写出下列物质的化学式B ,E 。
(2)H和 SO2生成强酸F,此反应中氧化剂是 。
(3)写出①的离子方程式: 。
(4)写出②的化学方程式: 。
(5)C溶液中滴入NaOH溶液有何现象 。
所发生反应的化学方程式为___________________,____________________。
I实验室用加热固体氯化铵和氢氧化钙的混合物制取氨,反应的化学方程式为: 。所制得气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出适当选择,并将编号字母填入表中的空格处。
(1)装置:
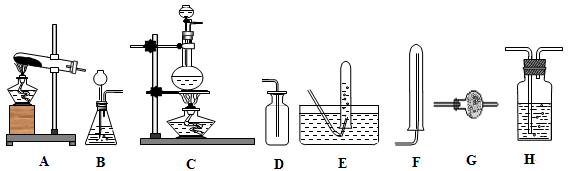
(2)试剂: a.NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液 e.碱石灰f.品红溶液 g.湿润的红色石蕊试纸
| 制取 气体 |
杂质气体 |
制取气体的 发生装置 |
除去杂质气体的净化装置 |
收集 装置 |
净化装置内 所用试剂 |
检验制得气 体所用试剂 |
| NH3 |
H2O(g) |
|
|
|
|
|
II如图所示,在干燥的圆底烧瓶里充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。立即倒置烧瓶,使玻璃管插入盛有水的烧杯里(预先在水里滴入少量酚酞溶液)。打开橡皮管上的夹子,轻轻挤压滴管,使少量水进入烧瓶,可观察到的现象为:____ 。
足量铜与一定量浓硝酸反应后过滤,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与3.36 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得溶液中加入1 mol/L NaOH溶液至Cu2+恰好完全沉淀,将沉淀过滤、洗涤、干燥、灼烧后得到黑色固体,则所得黑色固体的质量是( )
| A.12g | B.16g | C.24g | D.48g |
硝酸在化学工业中有着极其广泛的应用。
(1)将1.25 mol的NO、NO2、N2O4混合物(其中NO的体积分数为0.60)通入水中,在空气充足的条件下完全反应后可获得硝酸的物质的量范围是_______________。
(2)向稀硝酸中加入18.4 mol/L的浓硫酸(98%)作吸水剂并蒸馏得浓硝酸,当其浓度下降到87%(密度1.8 g/cm3)以下时,则失去吸水能力。50 mL 18.4 mol/L的浓硫酸作为吸水剂时,最多可吸水_________ g。
(3)在65%的HNO3(质量m1)中加入72%的Mg(NO3)2(质量m2)后蒸馏,分别得到97.5%的HNO3和60%的Mg(NO3)2溶液(其中不含硝酸)。若蒸馏过程中,硝酸、硝酸镁均无损耗,H2O的损耗占总质量的5%,则蒸馏前投料比 =______________。
=______________。
(4)硝酸工业中的尾气用烧碱进行吸收产物为NaNO2、NaNO3和H2O。现有含0.50mol氮氧化物的尾气,恰好被一定量的NaOH溶液完全吸收。已知反应后溶液含有0.35molNaNO2。若将尾气NO和NO2的平均组成用NOx表示,则x = 。
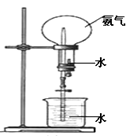
三氯化磷(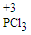 )和三氯氧磷(POCl3)是两种遇水会强烈水解的物质。PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料。
)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质。PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料。
I.白磷和Cl2化合制PCl3
已知白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3;POCl3能溶于PCl3。实验室制取PCl3的装置示意图和有关数据如下:
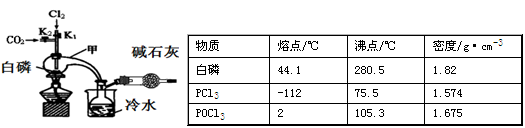
实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作顺序是:打开K2,使体系中充满CO2,再加入白磷,打开K1,通入氯气,再加热。
(1)干燥管中碱石灰的作用是_______________。
(2)PCl3强烈水解的产物是H3PO3和HCl,PC13遇水所得溶液中除OH-之外其它离子的浓度由大到小的顺序是____________________(己知亚磷酸H3PO3是二元弱酸:H3PO3 H++ H2PO3-,H2PO3-
H++ H2PO3-,H2PO3- H++HPO32-)。
H++HPO32-)。
(3)实验制得的粗产品中常含有POCl3、PC15等,PC15先用白磷除去后,再用____________方法除去PC13中的POCl3制备纯净的PCl3。
A.萃取 B.过滤 C.蒸馏 D.蒸发结晶
II.氯化水解法生产POC13
主要反应是:PC13+C12+H2O=POC13+2HCl,流程如下:
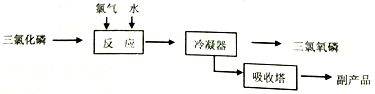
(1)若将0.01mol POCl3加到水中水解,再与含2.4gNaOH的溶液混合充分反应,并配成1L的溶液,取出少量的溶液于试管中,再向其中逐滴加入0.010mol/L的AgNO3溶液,则先产生的沉淀是_____________[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]。
(2)通过下列方法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
A.取ag产品于锥形瓶中,加入足量NaOH 溶液,再加稀硝酸至酸性。
B.向锥形瓶中加入0.1000 mol/L的AgNO3溶液40.00mL,使Cl-完全沉淀。
C.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
D.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积bmL。
己知:AgSCN是白色沉淀,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是_____________(填字母序号),滴定终点的现象为_________________。
A.FeCl2 B.NH4Fe(SO4)2 C.淀粉 D.甲基橙
②实验过程中加入硝基苯的目的是覆盖氯化银,防止沉淀转化生成AgSCN而导致数据不准确。如无此操作,所测Cl元素含量将会______________(填“偏大”、“偏小”或“不变”)。
③根据上面实验数据计算三氯氧磷产品中Cl元素的含量为______________。
某固体混合物可能含有Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2、NaCl中的一种或几种,现对该混合物做如下实验,所得现象和有关数据如图(气体体积已换算成标准状况下体积):下列说法不正确的是( )
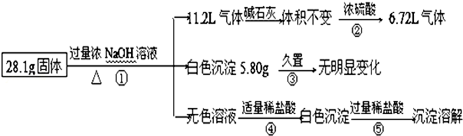
| A.混合物中一定不存在FeCl2和NaCl |
| B.反应④的离子方程式为:AlO2﹣+H++H2O=Al(OH)3↓ |
| C.混合物中一定含有Al、(NH4)2SO4、MgCl2三种物质,无法判断是否含有AlCl3 |
| D.白色沉淀5.80g是Mg(OH)2 |
m g铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加a mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中错误的是
| A.沉淀中OH-的质量为(n-m)g |
| B.恰好溶解后溶液中的NO3-的物质的量为aVmol |
C.反应过程中转移的电子的物质的量为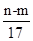 mol mol |
D.与合金反应的硝酸的物质的量为 mol mol |