(14分)氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)某课外学习小组欲制备少量NO气体,写出铁粉与足量稀硝酸反应制备NO的离子方程式: 。
(2)LiFePO4是一种新型动力锂电池的电极材料。
①下图为某LiFePO4电池充、放电时正极局部放大示意图,写出该电池放电时正极反应方程式: 。

②将LiOH、FePO4·2H2O(米白色固体)与还原剂葡萄糖按一定计量数混合,在N2中高温焙烧可制得锂电池正极材料LiFePO4。焙烧过程中N2的作用是 ;实验室中以Fe3+为原料制得的FePO4·2H2O有时显红褐色,FePO4·2H2O中混有的杂质可能为 。
(3)磷及部分重要化合物的相互转化如图所示。

①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是 。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1molCuSO4所能氧化的白磷的物质的量为 。
③步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有 。
某化学小组模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。请回答下列问题:
(1)写出装置A中主要反应的化学方程式 。
(2)实验结束后,关闭止水夹b、c,将装置D,浸入冰水中,现象是 。
(3)装置C中浓H2SO4的作用是 。
(4)请你帮助该化学小组设计实验室制取NH3的另一方案 。
(5)干燥管中的碱石灰用于干燥NH3,某同学思考是否可用无水氯化钙代替碱石灰,并设计下图所示装置(仪器固定装置省略未画)进行验证。实验步骤如下:
①用烧瓶收集满干燥的氨气,立即塞上如图所示的橡胶塞。
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可以观察到的现象 是 ,由此,该同学得出结论:不能用CaCl2代替碱石灰。
现有一定量的Cu和CuO混合物,向其中加入0.6 L 2.0 mol/L稀硝酸,混合物完全溶解,同时生成4.48 L NO(标准状况)。向所得溶液中加入一定体积1.0 mol/L NaOH溶液,恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧后得32.0 g固体。(忽略溶液的体积变化)。下列说法正确的是
| A.该混合物中铜的质量为19.2 g |
| B.与该混合物反应消耗的HNO3的量为1.2 mol |
| C.加入NaOH溶液的体积是800 mL |
| D.Cu2+沉淀完全后,溶液中c(NO3-)为0.7 mol/L |
(1)联氨(N2H4)是一种高能燃料。工业上可以利用氮气和氢气制备联氨。
已知:N2(g)+2H2(g)=N2H4(l) △H=" +" 50.6kJ·mol-1; 2H2(g)+O2(g)=2H2O(l) △H="-571.6" kJ·mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l) △H= kJ·mol-1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 。
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 。
(2)在纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,则N2H4发生分解反应的化学方程式为 。
(3)N2H4与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的相对分子质量为43.0,其中氮原子的质量分数为0.977。该氢化物受撞击后可完全分解为两种单质气体。该氢化物分解的化学方程式为 。
(4)氨氧化法制硝酸工业尾气中的NO、NO2气体可用氨水吸收,反应方程式为6NO+4NH3===5N2十6H2O,6NO2+8NH3===7N2+12H2O。若尾气中NO和NO2共18 mol被氨水完全吸收后,产生了15.6 mol N2,则此尾气中NO与NO2的体积比为 。
工业制硝酸经以下一系列反应: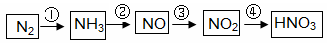
请回答:
(1)写出反应④的化学方程式 ,实验室收集NO的方法是 。
(2)对于氮的化合物,下列说法不正确的是(选填序号字母) 。
a.氨可用作制冷剂
b.铵态氮肥一般不能与碱性化肥共同使用
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol NO2
(3)已知:H2(g)+1/2 O2(g)=H2O(g) △H1=-241.8kJ/mol
N2(g)+ 3H2(g)=2NH3(g) △H2=-92.0kJ/mol
则34g氨气与氧气反应生成N2(g)与H2O(g)时,△H= kJ/mol。
(4)氨气在微生物的作用下与氧气反应生成HNO2,写出该反应的化学方程式 。
(5)氨气是氮肥工业的重要原料,某化肥厂生产铵态氮肥(NH4)2SO4的部分工艺流程如下: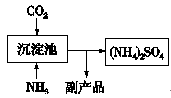
向装有CaSO4悬浊液的沉淀池中先通氨气,再通CO2的原因(请从溶解度和溶解平衡角度分析) 。
2014年德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,他们开创性的成就使光学显微镜分辨率步入了纳米时代。
Ⅰ.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
(1)实验室若用NH4Cl和熟石灰作试剂来制取、收集干燥的NH3,请选择装置并按气流方向连接各仪器接口 (填装置接口顺序),若要制取、收集干燥的CO2,则需选用上述仪器装置中的 (填装置序号)。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是 。试写出制纳米级碳酸钙的离子方程式 。
Ⅱ.纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(3)制备TiO2的常见方法:将TiCl4水解产物加热脱水生成TiO2。已知常温下Ti(OH)4的Ksp=7.94×10-54,测得TiCl4水解后溶液常温下的pH=2,则此时溶液中:c (Ti4+)= 。
(4)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要右图中的_______(填字母代号)。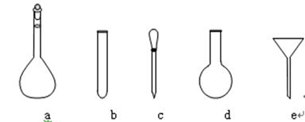
(5)滴定终点的现象是 。
(6)滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则试样中TiO2质量分数表达式为 。
Ⅲ.(7)纳米材料具有很多特殊的优良性能,其颗粒大小一般在1~100 nm之间。试设计简单的实验方案,判断Ⅰ、Ⅱ实验中所得样品颗粒是否为纳米级 。
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.60 mL | B.45 mL | C.30 mL | D.15 mL |
现有三种制取硝酸铜的实验方案可供选用:下列有关说法正确的是
①铜与稀硝酸反应制取:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
②铜与浓硝酸反应制取:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
③首先将铜屑在空气中加热生成氧化铜,氧化铜与稀硝酸反应制取:
2Cu+O2 2CuO,CuO+2HNO3==Cu(NO3)2+H2O
2CuO,CuO+2HNO3==Cu(NO3)2+H2O
| A.制取等量硝酸铜,需硝酸的量②最少 |
| B.制取等量的硝酸铜,②产生的有毒气体比①少 |
| C.三种方案中,第③方案最经济环保 |
| D.三种方案的反应都可以在铁质容器中进行 |
甲同学探究NO2的氧化性;设计了如下实验装置:
(1)该装置的明显缺陷是:________________________。
(2)实验开始后,发现Zn溶解,但未发现有气体逸出,同学猜想可能是因为HNO3被还原生成NH4+
写出反应的离子方程式:__________________,如何验证该猜想:_______________。
(3)重新调整HNO3浓度后,发现A中有红棕色气体逸出,设计实验,证明NO2具有氧化性(药品任意选择,合理即可)
| 步骤 |
现象 |
结论 |
| 取少量C中反应后的溶液 置于试管中,__________ |
__________ |
NO2具有氧化性 |
(4)乙同学对甲的实验结果产生质疑,提出假设:
假设一:NO2氧化了SO32-
假设二:HNO3氧化了SO32-
问题1:假设二_____(“是”或“否”)合理,
理由:___________________(用化学方程式回答)
问题2:若要验证NO2具有氧化性,你的实验方案是:_____________________。
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
(1)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应),当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 (填“变大”、“变小”或“不变”) 。
2NH3(g)(正反应为放热反应),当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 (填“变大”、“变小”或“不变”) 。
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: _________________。
(3)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是________。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若a mol CO和H2的混合气体(H2的体积分数为80%)与H2O反应,得到1.14a mol CO、CO2和H2的混合气体,则CO转化率为__________________。
上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)______。
简述本流程中提高合成氨原料总转化率的方法: 。
氮元素是地球大气中含量最多的元素。
(1)氮元素和碳元素一样也存在一系列氢化物并有广泛应用。例如:NH3、N2H4、N3H5、N4H6……。
①写出该系列氢化物的通式: 。
②N4H5Cl的同分异构体有 种。
(2)NH3、OH-、H2O结合质子(H+)的能力由强到弱的顺序是 ,其理由用两个反应的离子方程式表示为NH4++OH-= NH3+H2O和 。
(3)在碱性介质中,用N2H4与NO2可组合制成燃料电池,产物中无污染物,试写出该电池正极的电极反应式 。
(4)①CaCO3和适量稀HNO3溶液反应时,每产生4.4g气体(不考虑气体溶解),放热a kJ,则该反应的热化学方程式为___________________。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示。
请用离子方程式表示B-C段发生的反应: 。
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5,PCl3遇水会强烈水解生成 H3PO3和HCl。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为 。
(2)B中所装试剂是 ,E中冷水的作用是 F中碱石灰的作用是_____。
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后.通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入10.00 mL 0.1000 mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,假设测定过程中没有其他反应。根据上述数据,该产品中PC13的质量分数为_______。
除去工业尾气中的氮氧化物,常用氨催化吸收法。原理是NH3与NOx反应生成无毒物质。某同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。
(一)提供的装置

(二)NH3的制取
(1)下列有关实验室制备气体的说法正确的有 (填序号)。
①用赤热的炭与水蒸气反应制取氢气
②用排饱和食盐水的方法收集氯气
③实验室制氧气有时需要加热,有时不需要加热
④用无水氯化钙干燥氨气
(2)若选择装置G制取氨气,则分液漏斗中盛装的液体试剂是 。
(3)若选择装置C制取氨气,则反应的化学方程式是 。
(三)模拟尾气的处理
选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:
(4)A装置中反应的离子方程式为__________________________________。
(5)D装置中的液体可换成 (填序号)。
a. CuSO4 b. H2O c. CCl4 d. 浓硫酸
(6)该同学所设计的模拟尾气处理实验存在的明显缺陷是__________________。
(6分)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体,在标准状况下的体积为11.2 L。
计算:(1)产生的NO、 NO2体积各为多少升?
(2)待气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶
液中的Cu2+全部转化为沉淀,则原硝酸溶液的浓度为多少?